sølv
| eiendommer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[ Kr ] 4d 10 5 s 1
47 Ag
Periodiske tabell
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Som regel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Navn , symbol , atomnummer | Sølv, Ag, 47 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategori | Overgangsmetaller | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe , periode , blokk | 11 , 5 , d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | blank hvit, metallisk | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS -nummer |
7440-22-4 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EF -nummer | 231-131-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.301 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ATC -kode |
D08 AL30 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefraksjon av jordens konvolutt | 0,079 ppm [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 107.8682 (2) [3] et al | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (beregnet) | 160 (165) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 145.00 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 172 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfigurasjon | [ Kr ] 4d 10 5 s 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ioniseringsenergi | 7. 576 234 (25) eV [4] ≈ 731 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ioniseringsenergi | 21 . 4844 (9) eV [4] ≈ 2 072. 93 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ioniseringsenergi | 34 . 8 (3) eV [4] ≈ 3 358 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ioniseringsenergi | 49 . 0 (1.7) eV [4] ≈ 4 728 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ioniseringsenergi | 65 . 0 (1.9) eV [4] ≈ 6 272 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk tilstand | fikset | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystallstruktur | Kubisk områdesentrert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tetthet | 10,49 g / cm³ (20 ° C ) [6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardhet | 2,5 til 3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetisme | diamagnetisk ( Χ m = −2,4 · 10 −5 ) [7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 1234,93 K (961,78 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kokepunkt | 2483 K [8] (2210 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar volum | 10,27 · 10 −6 m 3 · mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 254 kJ / mol [8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusjonsvarme | 11,3 kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighet | 2600 m s −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spesifikk varmekapasitet | 235 (25 ° C, konstant trykk) J kg −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Arbeidsfunksjon | 4,26 eV [9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsevne | 61,35 · 10 6 A · V −1 · m −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termisk ledningsevne | 430 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidasjonstilstander | +1 , +2, +3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalt potensial | 0,7991 V (Ag + + e - → Ag) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,93 ( Pauling -skala ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For andre isotoper, se liste over isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| NMR -egenskaper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| MAK |
Sveits: 0,1 mg m −3 (målt som inhalerbart støv ) [12] |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toksikologiske data | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Så langt som mulig og vanlig brukes SI -enheter . Med mindre annet er angitt, gjelder dataene som gis for standardbetingelser . |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Sølv (også latin argentum i apotek) er et kjemisk element med elementets symbol Ag og atomnummer 47. Det er et av overgangsmetallene . I det periodiske systemet er det i den 5. perioden og den første undergruppen (gruppe 11) eller kobbergruppen. Elementsymbolet Ag stammer fra det latinske ordet a r g entum for "sølv" fra. Sølv er et av edelmetallene .
Det er et mykt, lett deformerbart ( duktilt ) tungmetall med den høyeste elektriske ledningsevne for alle elementer i umodifisert tilstand (karbon i form av grafen har en annen høyere konduktivitet) og den høyeste varmeledningsevnen til alle metaller . Bare superfluider og uforstyrrede krystallinske former for karbon ( diamant , grafen og grafitt nær grafitt , karbon -nanorør ) og bornitrid har bedre varmeledningsevne. [1. 3]
etymologi
Ordet "sølv" ( gammelhøjtysk silabar, silbar og lignende former) er avledet fra den vanlige germanske roten * silubra- , akkurat som navnene på andre germanske språk (for eksempel engelsk sølv ). Baskisk har adoptert det germanske ordet: zilar . Det er beslektede navn på de baltiske språkene ( litauiske sidebraer ) og de slaviske språkene ( russisk серебро
serebro , kroatisk srebro ). [14]Filologi fra 1800- tallet ga opphav til en rekke teorier om ordopprinnelse. [14] Forbindelsen etablert av Victor Hehn i 1870 med det legendariske landet Alybē ( Ἀλύβη ) beskrevet i Homers Iliaden må forbli spekulasjoner. Ordet kan komme fra et orientalsk språk, avledet fra den semittiske roten ṢRP (jf. Akkadisk
ṣarāpu , "edel, legering"). [15]På andre indoeuropeiske språk går ordet for sølv tilbake til roten * arg , så gammelgresk ἄργυρος
argyros og latin argentum . [16] Argentina ble oppkalt etter sølvet europeerne håpet å finne der; det er det eneste landet oppkalt etter et kjemisk element. Det er mer vanlig å kalle et element etter et land, f.eks. B. Francium , Germanium og Polonium . [17]historie
Sølv har blitt brukt av mennesker siden rundt det femte årtusen f.Kr. . Chr behandlet. Den ble for eksempel brukt av assyrerne , goterne , grekerne , romerne , egypterne og teutonene . Noen ganger ble det ansett som mer verdifullt enn gull . Det meste av sølvet kom fra gruvene i Laurion , omtrent 50 kilometer sør for Athen . Sølv var kjent for de gamle egypterne som månemetall. Også i alkymi står månen (Latin Luna ) [18] for sølv. Sent middelalderske og tidlige moderne forfattere, spesielt innen alkymi, antok at sølv ble dannet ved å blande svovel og kvikksølv (latin: Argentum vivum ). I medisin ble polert gull blant annet brukt som medisin mot epilepsi. [19]
I middelalderen og den tidlige moderne perioden ble det funnet sølvmalmforekomster i Sentral-Europa i Harz-fjellene ( Goslar ), i Waldeck-Frankenberg ( Frankenberg , Goddelsheim , Dorfitter , Thalitter ), på Donnersberg ( Imsbach ), i Thüringen Skog ( Ohrdruf ), i Sachsen ( Freiberg og andre malmfjell , spesielt Jáchymov ), oppdaget i den sørlige Schwarzwald ( Schauinsland , Belchen , Münstertal , Feldberg ), Böhmen ( Kutná Hora ) og Slovakia . Rikelige sølvforekomster er også kjent fra Kongsberg (Norge).
Den største sølvprodusenten i middelalderen var Schwaz . En stor del av datidens sølv kom fra tunnelene til Schwazer -gruvearbeiderne .
Senere tok spanjolene med seg store mengder sølv fra Latin -Amerika , inkludert fra den legendariske Potosí -gruven, til Europa. Japan var også en sølveksportør på 1500 -tallet. På grunn av det økte tilbudet falt verdien av sølv i den gamle verden.
Siden gull hovedsakelig ble brukt som valutametall etter 1870, mistet sølv mer og mer sin økonomiske betydning. Verdiforholdet falt fra 1:14 til 1: 100 en stund, senere steg det litt igjen. I mars 2018 var klokken rundt 1:81. Tilførselen av sølv avhenger av utviklingen av forbruk og produksjon av andre metaller.
På midten av 1800-tallet ble rustfritt stål utviklet, som på grunn av sin brukervennlighet og attraktive pris gjorde sin vei til sølvapplikasjoner etter første verdenskrig , for eksempel serveringsplater, bestikk, lysestaker og kjøkkenutstyr. I motsatt retning har feltet fotografering og fotokjemi ved bruk av sølvsalter utviklet seg bredt gjennom det 20. århundre, men har mistet mye av sin betydning siden slutten av 1990 -tallet i løpet av overgangen til digital bildebehandlingsteknologi.
Den største sølvspekulasjonen anses å være boblen i sølvmarkedet fra midten av 1970-tallet til 1980, som er spesielt knyttet til brødrene Nelson Bunker Hunt og William Herbert Hunt, sølvspekulasjonen til Hunt-brødrene .
Sølv som mineral og varianter
Sølv har en andel på omtrent 0,079 ppm i jordskorpen . Det er rundt 20 ganger mer vanlig enn gull og rundt 700 ganger mindre vanlig enn kobber . [1] I naturen forekommer det verdig , det vil si elementært; hovedsakelig i form av korn, mer sjelden av større nuggets , tynne plater og ark eller som et trådete, forgrenet maske ( dendrit ) eller som tynne sølvtråder i hydrotermisk dannede malmårer og i sementeringsområdet .
Naturlige forekomster av innfødt sølv var kjent allerede før International Mineralogical Association (IMA) ble grunnlagt. Sølv blir derfor anerkjent som et såkalt bestefarlig mineral som en uavhengig type mineral. [20]
I følge systematikken for mineraler i henhold til Strunz (9. utgave) , er sølv klassifisert under systemnr. "1.AA.05" (elementer - metaller og intermetalliske forbindelser - kobberkuppalittfamilie - kobbergruppe) [21] eller i den utdaterte 8. utgaven klassifisert under I / A.01 (kobberserie). Systematikken til mineraler ifølge Dana , som hovedsakelig brukes i engelsktalende land , viser elementet mineral under systemnr. "01.01.01.02" (gullgruppe). [22]
I tillegg til solid sølv, hvorav mer enn 5500 steder er dokumentert så langt (fra og med 2018), [23] finnes det hovedsakelig i sulfidiske mineraler. Den viktigste sulfidiske sølvmalmer omfatter acanthite (sølv glans) Ag 2 S med et sølvinnhold på rundt 87% og stromeyerite (kobber sølv glans) CuAgS med ca 53% sølv. Mineralet med det høyeste sølvinnholdet på maksimalt 99% er imidlertid det sjelden forekommende allargentum . Sølvmineraler som også forekommer sjelden inkluderer Chlorargyrite (foreldet Hornerz eller Silberhornerz) AgCl og Miargyrit (Silver stibnite) AgSbS andre Totalt er 167 sølvmineraler inkludert naturlig sølv kjent så langt (fra 2018). [24]
I tillegg til disse sølvmalmene er det også såkalte sølvholdige malmer, som vanligvis bare inneholder små mengder sølv (0,01–1%). Disse er ofte galena (PbS) og chalcopyrite (CuFeS 2 ). Av denne grunn blir sølv ofte ekstrahert som et biprodukt i bly- eller kobberproduksjon.
En teknikk kalt Kongsbergit sølvamalgam med et kvikksølvinnhold på omtrent 5% brukes som en variant som tilskrives sølvet. Så langt er Kongsbergite kjent fra litt mer enn 30 lokaliteter. [25]
Arquerite er en rekke av sølv (sølvamalgam) med et kvikksølvinnhold på 10 til 15%. [26]
Chilenite er en sølvholdig vismut . [26]
En sølvvariant med et innhold på mellom 10 og 30% gull er kjent som Küstelite og har så langt (fra 2011) blitt påvist på rundt 60 steder. [27]
Det har vært kjent siden 1700 -tallet at kunstig ( antropogenisk ) produserte sølvtråder, hovedsakelig i form av sølvkrøller, kan opprettes ved oppvarming av akantitt eller ved smelting av sølvmalm. [28] Spesielt de siste tiårene har det vært gjentatte rapporter i faglitteraturen om kunstig produksjon av sølvkrøller på akantittnivåer [29] .
Forekomst og ekstraksjon
De viktigste sølvforekomstene er i Nord -Amerika ( Mexico , USA og Canada ) og i Sør -Amerika ( Peru , Bolivia ). Med nesten 20% av den globale produksjonen var Peru verdens største sølvprodusent fra 2003 til 2009 og ble forbikjørt av Mexico i 2010. [30] I 2017 produserte Mexico mest sølv på verdensbasis med 6110 tonn, etterfulgt av Peru med 4300 tonn. [31]
Det meste sølv utvinnes fra sølvmalm, som ofte finnes sammen med bly, kobber og sinkmalm som sulfider eller oksider . Viktige sølvsteder i verdig form var: Freiberg i Erzgebirge ; Schwaz (Tyrol) ; Kongsberg / Norge (der også store krystaller); Sankt Andreasberg i Harz -fjellene; Keweenaw Peninsula / USA (der med også innfødt kobber som "halvras"); Batopilas / Mexico; Mansfeld kobber skifer distrikt ( Eisleben , Sangerhausen ; for det meste sølvplater; brukes også som fossilt materiale for fossiler).
Mellom begynnelsen av 1900 -tallet og slutten av andre verdenskrig varierte mengden sølv som ble utvunnet årlig, men i gjennomsnitt forble den konstant. Fra slutten av krigen til i dag har den mer enn doblet seg.
Det polske selskapet KGHM er det viktigste sølvfirmaet i EU og det tredje største i verden, med et gjennomsnitt på 1200 tonn årlig produksjon .
Ifølge en studie fra Rhenish-Westphalian Institute for Economic Research , Fraunhofer Institute for Systems and Innovation Research og Federal Institute for Geosciences and Raw Materials , er den globale rekkevidden til sølvressurser bare 29 år. Det er derfor forventet mangel på sølv i løpet av de neste tiårene. Imidlertid blir mer og mer sølv også resirkulert , noe som beskytter de kjente forekomstene. [32] Basert på dataene fra US Geological Survey fra januar 2019 [31] resultater for sølv i forhold til 2017, et statisk område på 21 år.
Som med de andre edle metallene spiller opparbeiding av sølvholdige materialer en viktig rolle i resirkulering , for eksempel fotopapir , røntgenfilmer , utvikler- og fikseringsbad, elektronisk skrap og batterier .
| rang | land | Leveringspriser (i t ) |
rang | land | Leveringspriser (i t ) |
|
|---|---|---|---|---|---|---|
| 1 |
|
6110 | 7 |
|
1200 | |
| 2 |
|
4300 | 8 |
|
1120 | |
| 3 |
|
3500 | 9 |
|
1030 | |
| 4. |
|
1290 | 10 |
|
1020 | |
| 5 |
|
1260 | hvile | 4770 | ||
| 6. |
|
1240 | Total | 26800 | ||
Uttrekk og presentasjon
Ekstraksjon fra sølvmalm
20% av sølvet er hentet fra sølvmalm. Sølvet ekstraheres vanligvis fra disse ved cyanidutvasking ved hjelp av en 0,1% natriumcyanidløsning . For å gjøre dette blir malmen først finmalt til et slam . Natriumcyanidoppløsningen tilsettes deretter. God ventilasjon er viktig fordi prosessen krever oksygen .
Med tilsetning av natriumcyanid går både elementært sølv og sølvmalm (Ag 2 S, AgCl) som dicyanoargentat (I) [Ag (CN) 2] - i løsning:
- ,
- ,
- .
Siden reaksjonen mellom natriumcyanid og sølvsulfid er i likevekt, må natriumsulfidet fjernes enten ved oksidasjon med oksygen eller ved utfelling (f.eks. Som bly -sulfid). Deretter utfelles det edlere sølvet med sink - i likhet med gullgruvedrift:
- .
Det utfelte råsølvet ( fabrikksølv [33] ) filtreres fra og renses ytterligere (se raffinering ).
Ekstraksjon fra blymalm
Ved ekstraksjon av blymalm, f.eks. B. fra bly glans , etter steking og redusere den såkalte rå bly eller arbeidsledningen (mer detaljert informasjon om bly ekstraksjon i artikkelen bly ). Denne inneholder vanligvis fortsatt en andel sølv (mellom 0,01 og 1%). I det neste trinnet fjernes edelmetallet og dette verdifulle biproduktet oppnås.
For å få det må sølvet først skilles fra det meste av blyet. Dette skjer gjennom prosessen med Parkesierens (etter Alexander Parkes , som oppfant denne prosessen i 1842). [34] Metoden er basert på ulik løselighet av sølv og bly i sink . Ved temperaturer opp til 400 ° C er bly (væske) og sink (fast stoff) praktisk talt ublandbart. Først tilsettes sink til det smeltede blyet ved temperaturer> 400 ° C. Blandingen avkjøles deretter. Siden sølv er lett oppløselig i smeltet sink, endres det til sinkfasen. Sink smelte deretter størkner som et såkalt sink skum (sink-sølv-blandingskrystaller). Dette gjør at sølvet kan skilles fra det meste av blyet. Dette sinkskummet er også kjent som armledning . Den blir deretter oppvarmet til blyets smeltepunkt (327 ° C) slik at en del av blyet smelter og kan fjernes. Den gjenværende sink-bly-sølvsmelten oppvarmes deretter til kokepunktet for sink (908 ° C) og sink destilleres av. Produktet oppnådd på denne måten kalles rik bly og inneholder rundt 8–12% sølv.
For å berike sølvet utføres nå det såkalte tvangsarbeidet ( raffinering ). For dette er det rike blyet i en ildovn smeltet. En luftstrøm føres deretter gjennom smelten. Blyet oksiderer til blyoksid , mens det edle sølvet forblir uendret. Blyoksydet tømmes kontinuerlig, og blyet fjernes gradvis. Hvis blyinnholdet i raffinatet har sunket så langt at det ikke lenger dannes et matt blyoksydlag på overflaten av det smeltede metallet, åpnes det siste tynne oksidlaget og det skinnende sølvet under blir synlig, dette kalles sølvet se . Legeringen som da er tilgjengelig kalles Blicksilber og består av over 95% sølv.
Ekstraksjon fra kobbermalm
Sølv finnes også i kobbermalm . Under kobberproduksjon oppnås sølvet - sammen med andre edle metaller - i det som kalles anodeslam . Dette frigjøres først fra majoriteten av det gjenværende kobberet med svovelsyre og luft. Det smeltes deretter på en oksidasjonsmåte i ovnen, hvorved de grunnleggende metaller går inn i slagget og kan fjernes.
Raffinering
Rå sølv rengjøres elektrolytisk ved hjelp av Moebius -prosessen . For dette formålet er råsølvet koblet til en elektrolysecelle som en anode. Et fint sølv ark tjener som katode og salpetersyre sølvnitrat oppløsning som elektrolytt .
Prosessen tilsvarer elektrolytisk rengjøring av kobber. Under elektrolysen oksyderes sølv og alle de mindre edle komponentene i råsølvet (for eksempel kobber eller bly) og går i løsning. Mer edle deler som gull og platina kan ikke oksideres og falle under elektroden. Dort bilden sie den Anodenschlamm, der eine wichtige Quelle für Gold und andere Edelmetalle ist. An der Kathode wird nun ausschließlich Silber abgeschieden. Dieses sehr reine Silber bezeichnet man als Elektrolyt- oder Feinsilber. [35]
Eigenschaften
Physikalische Eigenschaften
Silber ist ein weißglänzendes Edelmetall . Das Metall kristallisiert im kubischen-flächenzentrierten Kristallsystem . Unter Normaldruck betragen die Schmelztemperatur 961 °C und die Siedetemperatur 2212 °C. Silber hat aber bereits oberhalb von 700 °C, also noch im festen Zustand, einen deutlichen Dampfdruck . Es siedet unter Bildung eines einatomigen, blauen Dampfes. Das Edelmetall besitzt eine Dichte von 10,49 g/cm³ (bei 20 °C) und gehört daher wie alle Edelmetalle zu den Schwermetallen.
Silber hat einen metallischen Glanz. Frische, unkorrodierte (Schnitt)flächen von Silber zeigen die höchsten Licht-Reflexionseigenschaften aller Metalle, frisch abgeschiedenes Silber reflektiert über 99,5 % des sichtbaren Lichtes. Als „weißestes“ aller Gebrauchsmetalle wird es daher auch zur Herstellung von Spiegeln [36] benutzt. Strichfarbe ist ein gräuliches Weiß. Mit abnehmender Korngröße wird die Farbe immer dunkler und ist bei fotografisch fein verteilten Silberkristallen schwarz. Das Reflexionsspektrum zeigt im nahen UV eine ausgeprägte Plasmakante .
Silber leitet von allen Metallen Wärme und Elektrizität am besten. Wegen seiner Dehnbarkeit und Weichheit ( Mohshärte von 2,5–4) lässt es sich zu feinsten, blaugrün durchschimmernden Folien ( Blattsilber ) von einer Dicke von nur 0,002 bis 0,003 mm aushämmern oder zu dünnen, bei 2 km Länge nur 0,1 bis 1 g wiegenden Drähten (Filigrandraht) ausziehen.
Im geschmolzenen Zustand löst reines Silber leicht aus der Luft das 20-fache Volumen an Sauerstoff, der beim Erstarren der Schmelze unter Aufplatzen der bereits erstarrten Oberfläche ( Spratzen ) wieder entweicht. Bereits gering legiertes Silber zeigt diese Eigenschaft nicht.
Chemische Eigenschaften
Silber ist ein Edelmetall mit einem Normalpotential von +0,7991 V. Aus diesem Grund ist es relativ reaktionsträge. Es reagiert auch bei höherer Temperatur nicht mit dem Sauerstoff der Luft. Da in der Luft spurenweise Schwefelwasserstoff H 2 S enthalten ist, laufen Silberoberflächen allerdings mit der Zeit schwarz an, da elementares Silber mit Schwefelwasserstoff in Anwesenheit von Luftsauerstoff Silbersulfid (Ag 2 S) bildet:
- .
Silber löst sich nur in oxidierenden Säuren, wie beispielsweise Salpetersäure . In nichtoxidierenden Säuren ist es nicht löslich. Auch in Cyanid-Lösungen löst es sich bei Anwesenheit von Sauerstoff durch die Bildung eines sehr stabilen Silbercyanid-Komplexes, wodurch das elektrochemische Potential stark verschoben ist. In konzentrierter Schwefel- und Salpetersäure löst sich Silber nur bei erhöhten Temperaturen, da es durch Silbernitrat und -sulfat passiviert ist. Silber ist stabil gegen geschmolzene Alkalihydroxide wie Natriumhydroxid . Im Labor verwendet man darum für diese Schmelzen auch Silber- anstatt Porzellan- oder Platintiegel.
Biologisch-medizinische Eigenschaften
Silber wirkt in feinstverteilter Form bakterizid , also schwach toxisch , was aufgrund der großen reaktiven Oberfläche auf die hinreichende Entstehung von löslichen Silberionen zurückzuführen ist. Im lebenden Organismus werden Silberionen jedoch in der Regel schnell an Schwefel gebunden und scheiden aus dem Stoffkreislauf als dunkles, schwer lösliches Silbersulfid aus. Die Wirkung ist oberflächenabhängig. Dies wird in der Medizin genutzt für Wundauflagen wie für invasive Geräte (z. B. endotracheale Tuben). [37] In der Regel wird Silber für bakterizide Zwecke daher in Medizinprodukten als Beschichtung oder in kolloidaler Form eingesetzt, zunehmend auch Nanosilber. Silberionen finden als Desinfektionsmittel und als Therapeutikum in der Wundtherapie Verwendung. Sie können silberempfindliche Erreger nach relativ langer Einwirkzeit reversibel inhibieren, können darüber hinaus bakteriostatisch oder sogar bakterizid (also abtötend) wirken. Man spricht hier vom oligodynamischen Effekt. In manchen Fällen werden Chlorverbindungen zugesetzt, um die geringe Wirksamkeit des Silbers zu erhöhen.
Dabei kommen verschiedene Wirkmechanismen zum Einsatz: [38]
- Blockierung von Enzymen und Unterbindung deren lebensnotwendiger Transportfunktionen in der Zelle,
- Beeinträchtigung der Zellstrukturfestigkeit,
- Schädigung der Membranstruktur.
Die beschriebenen Effekte können zum Zelltod führen.
Neben der Argyrie , einer irreversiblen schiefergrauen Verfärbung von Haut und Schleimhäuten, kann es bei erhöhter Silberakkumulation im Körper außerdem zu Geschmacksstörungen und Riechstörungen sowie zerebralen Krampfanfällen kommen. Silber reichert sich in der Haut, der Leber , den Nieren , der Hornhaut der Augen, im Zahnfleisch , in Schleimhäuten , Nägeln und der Milz an. [39]
Umstritten ist die therapeutische Einnahme von kolloidalem Silber , das seit einigen Jahren wieder verstärkt ins Blickfeld der Öffentlichkeit rückt und über Internet und andere Kanäle vermarktet wird. Es wird vor allem als Universal antibiotikum angepriesen und soll noch andere Leiden kurieren können. Wissenschaftliche Studien über die Wirksamkeit gibt es nicht. Bereits die mit einem gängigen Antibiotikum vergleichbare Wirkung ist bei peroraler Verabreichung stark anzuzweifeln. Sehr geringe oral aufgenommene Mengen bis 5 Mikrogramm Silber pro Kilogramm Körpergewicht und Tag sollen nach Ansicht der amerikanischen Umweltschutzbehörde EPA zu keiner Vergiftung führen. [40]
Silber wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft ( CoRAP ) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Silber waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung. Die Neubewertung fand ab 2014 statt und wurde von den Niederlanden durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht. [41] [42]
Mythologische Eigenschaften
Silber gilt in vielen Märchen und Sagen als das einzige Metall, das in der Lage ist, Werwölfe und andere mythologische Wesen zu töten, was auch in modernen Fantasy -Romanen und Filmen häufig aufgegriffen wird. [43]
Verwendung
Silberpreis
Der Preis des Silbers wird auf dem offenen Markt bestimmt. Das geschieht seit dem 17. Jahrhundert am London Bullion Market . Die Einführung des Silberfixings 1897 in London markiert den Beginn der Marktstruktur. 1987 wurde die London Bullion Market Association (LBMA) gegründet. Drei LBMA-Mitglieder nehmen am Silberfixing an jedem Arbeitstag unter Vorsitz der ScotiaMocatta teil. Weitere Mitglieder des Silberfixings sind die Deutsche Bank AG London und HSBC Bank USA NA London Branch.
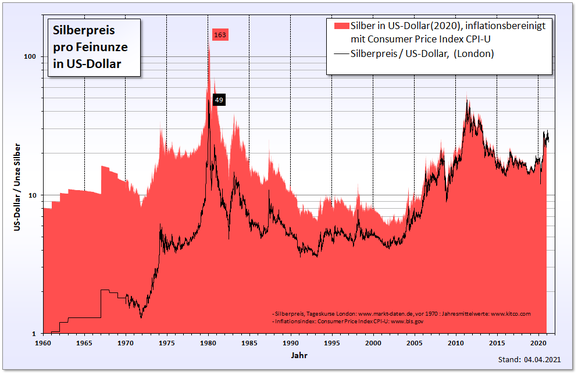
In den 1970er Jahren führte die Silberspekulation der Brüder Hunt zu einem Rekordstand beim Silberpreis . Diese kauften im Zusammenspiel mit vermögenden Geschäftsleuten aus Saudi-Arabien riesige Mengen an Silber sowie Silberkontrakten an den Warenterminbörsen und versuchten, den Silbermarkt zu beherrschen. [44] Am 18. Januar 1980 wurde beim Silberfixing am London Bullion Market ein Rekordstand von 49,45 US-Dollar pro Feinunze ermittelt. Den nächsten Rekord erreichte der Silberpreis erst über 31 Jahre später, am 25. April 2011, als die Feinunze Silber in Hong Kong mit 49,80 US-Dollar gehandelt wurde. Dem Inflationsrechner des United States Department of Labor zufolge entsprechen 49,45 US-Dollar von 1980 im Jahr 2011 einer Summe von 134,99 US-Dollar. [45] Daher dürfte es noch lange dauern bis der Preis von 1980 unter Berücksichtigung der Inflation überschritten wird.
Für den standardisierten Silberhandel an Rohstoffbörsen wurde „ XAG “ als eigenes Währungskürzel nach ISO 4217 vergeben. Es bezeichnet den Preis einer Feinunze Silber (31,1 Gramm).
Währung und Wertanlage
Die früher wichtigste Verwendung war die Herstellung von Silbermünzen als Zahlungsmittel. Für Münzen wurde in der Antike und im Mittelalter nur Silber, Gold und Kupfer bzw. Bronze verwendet. Der Münzwert entsprach weitgehend dem Metallwert ( Kurantmünze ). In Deutschland waren bis 1871 Silbermünzen ( Taler ) vorherrschend, die Währung war durch Silber gedeckt ( Silberstandard ). Nach 1871 wurde der Silber- durch den Goldstandard abgelöst. Der Grund für die Verwendung dieser Edelmetalle waren die hohe Wertspeicherung (Seltenheit) und Wertbeständigkeit von Silber und Gold. Erst in moderner Zeit werden Münzen auch aus anderen Metallen, wie Eisen, Nickel oder Zink hergestellt, deren Metallwert aber geringer ist und nicht dem aufgeprägten Wert entspricht ( Scheidemünze ). Silber wird als Münzmetall heute meist nur noch für Anlage- , Gedenk- und Sondermünzen verwendet.
Besonders in Zeiten von Wirtschaftskrisen – wie z. B. ab 2007 – hat sich neben Gold auch das Edelmetall Silber durch seine Kurs- und Wertstabilität als eine der wichtigsten Anlageform in verschiedensten Ausprägungen wie z. B. Silberbarren, Silberschmuck oder Silbermünzen erwiesen. [46] Im Umfeld von Währungskrisen gab es seit der Antike mehrmals in der Geschichte ein Silberverbot (s. Goldverbot ).
Wirtschaft und Sport
Silber ist neben Gold und Edelsteinen (z. B. Diamanten ) ein wichtiges Material für die Herstellung von Schmuck und wird seit Jahrhunderten für erlesenes und wertbeständiges Essbesteck ( Tafelsilber ) und Sakrales Gerät verwendet. Silberstempel (Meistermarke, Stadtmarke, Steuermarke ua Punzen) geben Auskunft über die Herkunft des Gegenstandes. Bei Schmuck, Gerät und Barren kann der Silbergehalt, sofern angegeben, anhand des Feingehaltstempels abgelesen werden.
Silbermedaillen werden bei vielen Sportwettkämpfen, z. B. bei den Olympischen Spielen , als Zeichen für das Erreichen des zweiten Platzes verliehen. Die olympische Goldmedaille besteht ebenfalls zu 92,5 % aus Silber und ist lediglich mit 6 g reinem Gold vergoldet. Auch in anderen Bereichen werden Auszeichnungen häufig als „silbern“ bezeichnet. Beispiele sind Silberner Bär , Silberner Griffel , Silberner Schuh und Silbernes Lorbeerblatt .
Sehr begehrt ist es auch bei Musikinstrumenten , da es aufgrund seiner Dichte einen schönen, warmen Ton von sich gibt, leicht zu verarbeiten ist und z. B. bei der Querflöte das empfindliche Holz ersetzt.
Silber besitzt die höchste elektrische Leitfähigkeit aller Metalle, eine hohe Wärmeleitfähigkeit und eine ausgeprägte optische Reflexionsfähigkeit . Dadurch ist es für Anwendungen in Elektrik , Elektronik und Optik prädestiniert. Die Reflexionsfähigkeit von Glasspiegeln beruht auf der chemischen Versilberung von Glasscheiben. Dieses Prinzip wird auch bei der Fertigung von Christbaumschmuck, Optiken und Licht- oder Wärmereflektoren verwendet. Eine Suspension von Silberpulver in Klebstoffen macht sie zu elektrisch (und thermisch) leitfähigen Klebern.
Die Schwärzung der Silberhalogenide infolge ihres Zerfalls durch Licht und Entwicklung wird beim Fotopapier genutzt. Es bildete von etwa 1850 bis zur Verbreitung der Digitaltechnik die Grundlage der Fotografie .
Silber legierungen (mit Kupfer , Zink , Zinn , Nickel , Indium usw.) werden in der Elektrotechnik und Löttechnik als Lotlegierungen (sogenanntes Hartlöten ), Kontaktmaterialien (z. B. in Relais) und Leitmaterial (z. B. als Kondensatorbeläge) verwendet. Silberlegierungen werden aber auch in der Dentaltechnik und im dekorativen Bereich verwendet.
Silbergeschirre und -geräte geben beim Gebrauch immer etwas Silber an die Speisen und Getränke ab, was sich besonders bei manchen Getränken (Wein) in einem unangenehmen Metallgeschmack bemerkbar machen kann. Um dies zu vermeiden, werden silberne Trinkgefäße oft innen vergoldet. Durch Silbersulfid angelaufenes Silber wird entweder poliert oder chemisch reduziert (siehe Silberpflege ).
Silber in medizinischen und medizinnahen Anwendungen
Werkstoffe oder Beschichtungsverfahren nutzen die antibakterielle Wirkung von Silber in Medizinprodukten und anderen Anwendungen in Form von Silberbeschichtungen, als kolloidales Silber , Nanosilber oder in Form von Silberfäden. Beispiele in Medizinprodukten:
- Wundauflagen mit kolloidalem Silber oder Nanosilber
- Silberbeschichtungen endoskopischer Tuben
- Silberbeschichtung von Endoprothesen
- Kunststoffe mit Silberdotierung zur Anwendung in der Medizintechnik
- Silberhaltige Cremes als Arzneimittel und Kosmetika, z. B. bei Schuppen mit Hautpilzverdacht oder bei Neurodermitis
- Silberplatte als Knochenersatz, typischerweise Schädelknochen, etwa bei Lex Barker nach schwerer Kopfverletzung 1944. [47] In Münchhausens Reise nach Rußland und St. Petersburg (ab 1739) wird 1786 über einen trinkfesten General fabuliert, der "zugleich mit seinem Hute eine an demselben befestigte silberne Platte aufhob, die ihm statt des Hirnschädels diente."
Beispiele für Hygiene- und andere Anwendungen
- Silberfäden oder Silberionen hemmen in der antimikrobiellen Ausrüstung von Textilien das Wachstum von Bakterien auf der Haut und verhindern damit unangenehme Gerüche.
- Beschichtung von Oberflächen, z. B. in Kühlschränken, auf Küchenmöbeln, Lichtschaltern und anderen Gegenständen
- Antibakterielle Emaillierungen und Keramiken
- Silberbeschichtete Wasserfilterkartuschen
- Beläge von keramischen Kondensatoren für die Elektrotechnik/Elektronik
In Bezug auf die nichtmedizinische Anwendung von Silber empfiehlt dasBundesinstitut für Risikobewertung (BfR) vorerst generell auf den Einsatz von nanoskaligem Silber oder nanoskaligen Silberverbindungen in verbrauchernahen Produkten zu verzichten. [48]
Silber in der Katalyse
Silberkatalysatoren finden industrielle Anwendung in der Partialoxidation von Ethen zu Ethylenoxid bzw. von Methanol zu Formaldehyd. [49] [50] Durch die Bedeutung des Silbers für die Oxidationskatalyse sind zahlreiche Untersuchungen zur Wechselwirkung von Silberoberflächen mit Sauerstoff durchgeführt worden. Verschiedene Sauerstoffspezies sind an der Silberoberfläche, im oberflächennahen Bereich und im Silbervolumen lokalisiert. Neben Spezies, die auf das Substrat übertragen werden und mehr oder weniger selektiv zur Oxidation eines Moleküls führen, sind auch Zentren vorhanden, die eine katalytische Dehydrierung ermöglichen. Dies ist interessant im Zusammenhang mit der Tatsache, dass die Partialoxidation von Methanol zu Formaldehyd unterstöchiometrische Mengen an Sauerstoff erfordert. [51] Die Bildung der Sauerstoffspezies ist abhängig von der Temperatur, aber auch von der Art der Reaktionsatmosphäre. Bestimmte O-Spezies sind ex situ nicht nachweisbar und stellen hohe Anforderungen an die eingesetzten Charakterisierungsmethoden. [52] [53]
Silber katalysiert anderseits auch die Reduktion organischer Substrate durch Wasserstoff, z. B. die Hydrierung von α,β-ungesättigten Carbonylverbindungen. Die Wechselwirkung von H 2 mit Silberkatalysatoren ist – verglichen mit klassischen Hydrierkatalysatoren wie Platin – nur schwach ausgeprägt. [54] Ag-Katalysatoren sind deshalb in der Lage, Doppelbindungen von bi-/multifunktionellen Molekülen selektiv zu hydrieren (z. B. Hydrierung von Acrolein zu Allylalkohol).
Nichtmetallische und nicht bakterizide Silberanwendungen
Silber wird als Lebensmittelfarbstoff E 174 [55] auch im Speisenbereich verwendet, zum Beispiel für Überzüge von Süßwaren wie etwa Pralinen und in Likören . Silbersalze färben Glas und Emaille gelb.
Silberlegierungen
Silber ist mit vielen Metallen legierbar. Gut legieren lässt es sich mit Gold, mit Kupfer oder mit Palladium (ein Palladiumgehalt von 20 bis 30 Prozent macht das Silber anlaufbeständig ). In begrenztem Maße lässt sich Silber mit Chrom , Mangan oder Nickel legieren. Legieren erhöht zumeist die Härte des Silbers. Mit Cobalt oder Eisen lässt es sich nicht legieren.
Die wichtigsten Silberlegierungen sind heute Kupfer -Silber-Legierungen. Sie werden meist nach ihrem Feingehalt an Silber, angegeben in Tausendstel, bezeichnet. Die gebräuchlichsten Silberlegierungen haben einen Feingehalt von 800, 835, 925 und 935 Tausendstel Teile Silber. 925er Silber wird nach der britischen Währung Pfund Sterling als Sterlingsilber bezeichnet. Es gilt als die wichtigste Silberlegierung und wird ua zur Herstellung von Münzen, Schmuck und Besteck verwendet.
Im Hinblick auf den Export werden heute Korpuswaren vorwiegend aus einer Silberlegierung mit einem Feingehalt von 935/1000 hergestellt, da die Waren mit Silberloten gelötet werden, deren Feingehalt niedriger ist, um letztendlich dem gesetzlich geforderten Gesamtfeingehalt von beispielsweise 925/1000 zu genügen. Eine neuartige Legierung aus England ist Argentium ™ Sterling Silber, das nicht anlaufen soll. Auch bei stark beanspruchten Bestecken geht seit Jahren der Trend zum Sterlingsilber. Silberwaren werden in der Regel abschließend feinversilbert, Bestecke und Verschleißartikel hartversilbert. Durch die reine Silberbeschichtung werden die verkaufsfördernde, strahlendweiße Silberfarbe und ein stark vermindertes Anlaufen der Waren erreicht.
Eine im Mittelalter für die Verzierung von Kunstwerken verwendete Silberlegierung ist das Tulasilber , eine Legierung von Silber, Kupfer, Blei und Schwefel. Silber wird häufig auch vergoldet ; man nennt es mit einem aus dem Französischen beziehungsweise Lateinischen stammenden Wort dann „Vermeil“.
Verbindungen
Silber kommt in chemischen Verbindungen hauptsächlich in der Oxidationsstufe +I vor, die Oxidationsstufen +II, +III und +IV sind selten und meist nur in Komplexen stabil.
Oxide
- Silber(I)-oxid Ag 2 O ist ein dunkelbrauner Feststoff , der aus silberhaltigen Lösungen mit Basen , z. B. Natronlauge , ausfällt. Bei höheren Temperaturen zerfällt Ag 2 O in die Elemente .
Die Silberoxide mit Silber in Oxidationsstufen größer +I können nur auf elektrochemischem Wege dargestellt werden. Dies sind die Verbindungen Silber(I,III)-oxid AgO, Silber(II,III)-oxid Ag 3 O 4 und Silber(III)-oxid Ag 2 O 3 .
Halogenide
Zu den wichtigsten Silberverbindungen zählen die Silberhalogenide. Sie zersetzen sich im Licht und werden deshalb in der Analogfotografie gebraucht. Silberhalogenide sind außer dem Fluorid schwer in Wasser löslich und dienen zum Nachweis von Halogenid - Ionen .
- Silber(I)-fluorid AgF ist farblos und als einziges Silberhalogenid gut wasserlöslich. Es ist im Gegensatz zu den anderen Silberhalogeniden nicht lichtempfindlich .
- Silber(I)-chlorid AgCl ist ein weißes, kristallines wasserunlösliches Pulver. Es dient als Nachweis für Chloridionen . Außerdem wird es in Referenzelektroden und in der Analogfotografie verwendet.
- Silber(I)-bromid ist hellgelb und ebenfalls wasserunlöslich. Da es lichtempfindlicher als Silberchlorid ist, dient es sehr häufig als lichtempfindliche Schicht in der Analogfotografie.
- Silber(I)-iodid ist wie Silberbromid gelb und wasserunlöslich. Es wird selten auch in der Analogfotografie verwendet. Manchmal wird Silberiodid von Flugzeugen als Kondensationskeim zur Regenbildung versprüht.
- Silber(II)-fluorid AgF 2 ist eines der wenigen nicht komplexen zweiwertigen Silbersalze . Es wird als Fluorierungsmittel an Stelle von elementarem Fluor verwendet.
Weitere Verbindungen
- Silber(I)-sulfid Ag 2 S ist von allen Silbersalzen am schwersten wasserlöslich . Es ist schwarz und entsteht direkt aus den Elementen oder durch Versetzen silberhaltigen Lösungen mit Schwefelwasserstoff . Wenn Silberbesteck anläuft, besteht der dunkle Überzug ebenfalls aus Silbersulfid.
- Silbernitrat AgNO 3 ist die wichtigste Silberverbindung und Ausgangsstoff für die Herstellung der meisten anderen Silberverbindungen. Es ist leicht wasserlöslich und wird durch Auflösen von Silber in Salpetersäure hergestellt.
- Silbersulfat Ag 2 SO 4 entsteht beim Auflösen von Silber in konzentrierter Schwefelsäure .
- Silberazid AgN 3 und Silberacetylid Ag 2 C 2 sind hochexplosiv. Ersteres kann als Initialzünder von Sprengstoffen dienen. Das ebenfalls sehr explosive Silberfulminat AgCNO wird auch als Knallsilber bezeichnet.
- Silbercyanid AgCN ist ein hochgiftiges farbloses Pulver, das beim Versetzen von Silbersalzlösungen mit Cyanidionen ausfällt.
Silber in höheren Oxidationsstufen tritt beispielsweise im Tetrapyridinosilber(II)-persulfat – [Ag(C 5 H 5 N) 4 ]S 2 O 8 , im Kaliumtetrafluoroargentat(III) K[AgF 4 ] oder Caesiumhexafluoroargentat(IV) Cs 2 [AgF 6 ] auf. Die giftigen Silbercyanide werden ua in galvanischen Bädern zur Versilberung und Farbvergoldung (hellgelb-grünlichgelb) eingesetzt. Bei Silber(I) ist die Neigung zur Bildung von Komplexionen ausgeprägt, meist mit der Koordinationszahl 2. Diese Komplexionen sind mit Ausnahme des erst in stark salzsaurer Lösung entstehenden [AgCl 2 ] − nur in alkalischer oder neutraler Lösung beständig .
Nachweis
Beim Zutropfen von Halogenid -Lösung in die zu prüfende Flüssigkeit bilden sich beim Vorhandensein von Silber-Kationen Niederschläge, z. B.:
- Ag + (aq) + Cl − (aq) → AgCl (s)
Als Nachweisreaktion für Silbersalze erfolgt daher die Zugabe von Salzsäure oder Natriumchloridlösung. Es bildet sich ein weißer Niederschlag von Silberchlorid, der löslich in verdünntem Ammoniakwasser ist, wobei der Silberdiamminkomplex [Ag(NH 3 ) 2 ] + entsteht. Bei hohen Konzentrationen an Chlorid löst sich das Silberchlorid teilweise wieder auf, da sich komplexe Dichloroargentate(I) bilden:
- AgCl + Cl − → [AgCl 2 ] −
Der Niederschlag ist bei Iodid-Ionen ( AgI ) gelb-grünlich und in Ammoniakwasser unlöslich, bei Chlorid- und Bromid-Ionen ( AgCl , AgBr ) weißlich.
Heraldik
In der Heraldik wird Silber, wie auch Gold , als Metall bezeichnet, das zu den heraldischen Tinkturen zählt. Es wird häufig durch weiße Farbe wiedergegeben.
Siehe auch
- Silber/Tabellen und Grafiken
- Silberelektrolyte
- Galvanisierung
Literatur
- AF Holleman , E. Wiberg , N. Wiberg : Lehrbuch der Anorganischen Chemie . 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , S. 1452–1466.
- Günter Ludwig, Günter Wermusch : Silber. Aus der Geschichte eines Edelmetalls. Verlag Die Wirtschaft, Berlin 1986, ISBN 3-349-00101-7 .
Weblinks
- Mineralienatlas – Silber (Bilder, Vorkommen, technische Fakten) , Mineralienportrait Silber
Einzelnachweise
- ↑ a b AF Holleman , E. Wiberg , N. Wiberg : Lehrbuch der Anorganischen Chemie . 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , S. 1433.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus Silber. auf: webelements.com entnommen.
- ↑ CIAAW, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Eintrag zu silver in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Hrsg.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Abgerufen am 11. Juni 2020.
- ↑ a b c d e Eintrag zu silver bei WebElements, https://www.webelements.com , abgerufen am 11. Juni 2020.
- ↑ NN Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9 , S. 1509.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics . CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9 , S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data . 56, 2011, S. 328–337, doi:10.1021/je1011086 .
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5 , S. 361.
- ↑ a b c d e Eintrag zu Silber in der GESTIS-Stoffdatenbank des IFA , abgerufen am 13. April 2020. (JavaScript erforderlich)
- ↑ Datenblatt Silver, powder, 5-8 μm bei Sigma-Aldrich , abgerufen am 25. Juni 2020 ( PDF ).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 7440-22-4 bzw. Silber ), abgerufen am 25. November 2019.
- ↑ Wärmeleitfähigkeit. auf der Webseite der Technischen Fakultät der Uni Kiel.
- ↑ a b Vgl. Silber im Deutschen Wörterbuch der Brüder Grimm.
- ↑ Vgl. Online Etymology Dictionary zu Englisch silver .
- ↑ Vgl. Online Etymology Dictionary zu Englisch argent (für Silber als heraldische Farbe ).
- ↑ AF Holleman , E. Wiberg , N. Wiberg : Lehrbuch der Anorganischen Chemie . 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1 , S. 1452–1466.
- ↑ Wilhelm Hassenstein, Hermann Virl : Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 40.
- ↑ Wilhelm Hassenstein, Hermann Virl : Das Feuerwerkbuch von 1420. 600 Jahre deutsche Pulverwaffen und Büchsenmeisterei. Neudruck des Erstdruckes aus dem Jahr 1529 mit Übertragung ins Hochdeutsche und Erläuterungen von Wilhelm Hassenstein. Verlag der Deutschen Technik, München 1941, S. 103.
- ↑ IMA/CNMNC List of Mineral Names; July 2019 (PDF 1,67 MB; Silber siehe S. 178).
- ↑ IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Silber siehe S. 260).
- ↑ Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group .
- ↑ Mindat - Silver (englisch).
- ↑ Mineral Species containing Silver (Ag). auf: webmineral.com .
- ↑ Mindat - Kongsbergite .
- ↑ a b Stefan Weiß: Das große Lapis Mineralienverzeichnis. Alle Mineralien von A – Z und ihre Eigenschaften . 6., vollkommen neu bearbeitete und ergänzte Auflage. Weise, München 2014, ISBN 978-3-921656-80-8 .
- ↑ Mindat - Küstelite .
- ↑ Mineralienatlas : Anthropogene Silberlocken
- ↑ S. Jahn: Lockensilber aus Imiter - echt oder eine Fälschung? In: Min. Welt . Heft 6, 2008, S. 28–31.
- ↑ United States Geological Survey: Silver Statistics and Information
- ↑ a b c United States Geological Survey: World Mine Production and Reserves January 2019
- ↑ Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen. (PDF; 2,1 MB), Rheinisch-Westfälisches Institut für Wirtschaftsforschung (RWI Essen), Fraunhofer-Institut für System- und Innovationsforschung (ISI), Bundesanstalt für Geowissenschaften und Rohstoffe (BGR).
- ↑ Jörg Mildenberger: Anton Trutmanns Arzneibuch Teil II: Wörterbuch, Band V. Würzburg 1997, ISBN 3-8260-1398-0 , S. 2274.
- ↑ Geschichte des Kunststoffs - Alexander Parkes. auf: plasticker.de
- ↑ Anorganischer Experimentalvortrag: Silber S. 9, Elektrolytische Feinreinigung (Möbius-Verfahren). ( MS Word ; 1,1 MB).
- ↑ Ludwig Hartmann: Faraday an Liebig (1858): Zur Geschichte der Silberspiegelherstellung. In: Sudhoffs Archiv. 32, 1939/40, S. 397–398.
- ↑ Mit Silber beschichteter Tubus senkt Pneumonierisiko. In: aerzteblatt.de . 20. August 2008, archiviert vom Original am 26. Dezember 2014 ; abgerufen am 26. Dezember 2014 .
- ↑ JR Morones-Ramirez, JA Winkler ua: Silver enhances antibiotic activity against gram-negative bacteria. In: Science Translational Medicine . Band 5, Nummer 190, Juni 2013, S. 190ra81, doi:10.1126/scitranslmed.3006276 . PMID 23785037 .
- ↑ M. Glehr, A. Leithner, J. Friesenbichler, W. Goessler, A. Avian, D. Andreou, W. Maurer-Ertl, R. Windhager, P.-U. Tunn: Argyria following the use of silver-coated megaprostheses. In: The Bone and Joint Journal . Band 95-B, Ausgabe 7, Juli 2013, S. 988–992.
- ↑ Silver (CASRN 7440-22-4). auf der Webseite der amerikanischen Umweltschutzbehörde EPA.
- ↑ Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report .
- ↑ Community rolling action plan ( CoRAP ) der Europäischen Chemikalienagentur (ECHA): Silver , abgerufen am 20. Mai 2019.
- ↑ Robert Jackson: Witchcraft and the Occult. Quintet Publishing, Devizes 1995, S. 25.
- ↑ Steffen Uttich: Regeländerung mitten im Spiel. In: FAZ.net . 5. Juli 2008, abgerufen am 26. Dezember 2014 .
- ↑ Inflation Calculator .
- ↑ Michael Höfling: Silber-Rallye im Windschatten des Goldes. In: welt.de . 14. Oktober 2009, abgerufen am 26. Dezember 2014 .
- ↑ Inoffizielle Fanpage von Lex Barker – Biographie (abgerufen 31. Januar 2012).
- ↑ BfR rät von Nanosilber in Lebensmitteln und Produkten des täglichen Bedarfs ab , Stellungnahme von 2009 (PDF-Datei, 84 kB), abgerufen am 14. Februar 2012.
- ↑ PA Kilty, WMH Sachtler: The Mechanism of the Selective Oxidation of Ethylene to Ethylene Oxide. In: Catalysis Reviews . 10, 1974, S. 1–16; doi:10.1080/01614947408079624
- ↑ H. Sperber: Herstellung von Formaldehyd aus Methanol in der BASF. In: Chemie Ingenieur Technik . 41, 1969, S. 962–966; doi:10.1002/cite.330411705 .
- ↑ A. Nagy, G. Mestl, T. Rühle, G. Weinberg, R. Schlögl: The Dynamic Restructuring of Electrolytic Silver during the Formaldehyde Synthesis Reaction. In: Journal of Catalysis . 179, 1998, S. 548–559; doi:10.1006/jcat.1998.2240 .
- ↑ VI Bukhtiyarov, AI Nizovskii, H. Bluhm, M. Hävecker, E. Kleimenov, A. Knop Gericke, R. Schlögl: Combined in situ XPS and PTRMS study of ethylene epoxidation over silver. In: Journal of Catalysis. 238, 2006, S. 260–269;doi:10.1016/j.jcat.2005.11.043 .
- ↑ A. Knop-Gericke, E. Kleimenov, M. Hävecker, R. Blume, D. Teschner, S. Zafeiratos, R. Schlögl, VI Bukhtiyarov, VV Kaichev, IP Prosvirin, AI Nizovskii, H. Bluhm, A. Barinov, P. Dudin, M. Kiskinova: Chapter 4 X-Ray Photoelectron Spectroscopy for Investigation of Heterogeneous Catalytic Processes. In: Advances in Catalysis . 52, 2009, S. 213–272; doi:10.1016/S0360-0564(08)00004-7 .
- ↑ J. Hohmeyer: Charakterisierung von Silberkatalysatoren für die Selektivhydrierung mittels DRIFT-Spektroskopie, Adsorptionskalorimetrie und TAP-Reaktor. Dissertation . Fritz-Haber-Institut Berlin / Technische Universität Darmstadt, 2009.
- ↑ Eintrag zu E 174: Silver in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 16. Juni 2020.
- CoRAP-Stoff
- ATC-D08
- Umweltgefährlicher Stoff
- Gruppe-11-Element
- Übergangsmetall
- Schwermetall
- Periode-5-Element
- Chemisches Element
- Mineral
- Kubisches Kristallsystem
- Elemente (Mineralklasse)
- Silber
- Elektrotechnischer Werkstoff
- Zahlungsmittel
- Lebensmittelzusatzstoff (EU)





![{\ mathrm {2 \ Ag + H_ {2} O + \ ^ {1} / _ {2} \ O_ {2} +4 \ NaCN \ rightarrow \ 2 \ Na [Ag (CN) _ {2}] \ + \ 2 \ NaOH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fba93cd5116a374b26aa38f72742866453ea44dc)
![{\ mathrm {Ag_ {2} S \ +4 \ NaCN \ rightarrow \ 2 \ Na [Ag (CN) _ {2}] \ + \ Na_ {2} S}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a6bf0f1c4f727b94f22faf612ed38e2cb4885b6f)
![{\ mathrm {AgCl \ +2 \ NaCN \ rightarrow \ Na [Ag (CN) _ {2}] \ + \ NaCl}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2a590c9281279d9c39aa718d4ce1a2e9eef95360)
![{\ mathrm {2 \ Na [Ag (CN) _ {2}] \ + Zn \ høyre pil \ Na_ {2} [Zn (CN) _ {4}] + \ 2 \ Ag}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cd1b344603946cf96dec47c9df68b469b2610fa0)