enzym
Et enzym , tidligere kjent som gjæring , er et stoff som består av gigantiske biologiske molekyler og som fungerer som en katalysator for å akselerere en kjemisk reaksjon. De fleste enzymer er proteiner , med unntak av det katalytisk aktive RNA ( ribozym ), som f.eks. B. snRNA eller (naturlig ikke-forekommende, kunstig produsert) katalytisk aktivt DNA (deoksyribozym). Som med andre proteiner dannes de i cellen via proteinbiosyntese på ribosomene . Enzymer har viktige funksjoner i metabolismen av organismer : De kontrollerer de fleste biokjemiske reaksjonene - fra fordøyelse til transkripsjon ( RNA -polymerase ) og replikasjon ( DNA -polymerase ) av genetisk informasjon .
Opprinnelsen til ordet og historien til enzymforskning
Mennesker har brukt enzymer som gjær og bakterier i flere tusen år; så det er kjent at sumererne så tidlig som 3000 f.Kr. Brygger øl , baker brød og lager ost . For bruk av øl eller bakergjær , for eksempel mos eller i gjærdeig , og gjæringsprosessene som ble startet med det, ble begrepet "gjæring" opprettet uten å vite eksistensen av bakterier (eller mikrobielle gjær) og deres effekt gjennom enzymer.
Ordene gjæring og gjæring fant veien til det tyske språket på 1400 -tallet, de går tilbake til det latinske ordet fermentum . Columella brukte også dette uttrykket rundt 60 e.Kr. for å løsne og hevelse i jorda, mens Seneca brukte det omtrent samtidig i Epistulae for å beskrive en gjæringsprosess som han anså nødvendig for dannelsen av honning . [1] Med denne betydningen som "gjæringsmiddel" eller " surdeig ", ble ordet gjæring lånt fra latin, og gjæring , gjæring og gjæring avledet fra den. [2]
De første gjæringsprosessene ble beskrevet av Paracelsus og Andreas Libavius . De første forsøkene på å forklare dette kom fra Johann Baptist van Helmont og Georg Ernst Stahl . [1] Etter at René Réaumur hadde undersøkt fordøyelsen av fugler i 1752 og funnet ut at rovfugler ikke har snøstorm som hakker korn, men heller skiller ut en væske i magen, kunne Lazzaro Spallanzani i 1783 bevise at magesaften deres alene er tilstrekkelig til å flytende kjøtt . Dette tilbakeviste teorien om en rent mekanisk fordøyelsesprosess . [1]
Den første direkte bruken av enzymer uten involvering av mikroorganismer ble gjort av den tyske apotekeren Constantin Kirchhoff i 1811, da han oppdaget at større mengder sukker kan produseres ved oppvarming av stivelse med tilsetning av svovelsyre . Den franske kjemikeren Anselme Payen foredlet prosessen i 1833; siden det på den tiden ble antatt at sukkeret bare ble skilt fra stivelsen, ble denne prosessen kalt "diastase" (gresk for separat); i dag brukes begrepet "diastase" synonymt med amylase . Dette ble fulgt av oppdagelsen av Erhard Friedrich Leuchs i 1831 at det menneskelige spytt tilsynelatende sakkarifiserer stivelse. I 1833 brukte Eilhard Mitscherlich begrepet "gjæring" i forbindelse med et stoff som ikke transformeres under en reaksjon, men som er nødvendig for at en reaksjon skal komme i kontakt. I 1835 mistenkte den svenske kjemikeren Jöns Jakob Berzelius at diastase var en kjemisk prosess med virkning av katalytiske krefter.
I 1837 oppdaget de tre forskerne Charles Cagniard de la Tour , Theodor Schwann og Friedrich Traugott Kützing uavhengig av hverandre at gjær består av mikroorganismer. Louis Pasteur demonstrerte i 1862 at mikroorganismer er ansvarlige for gjæring; Han konkluderte med at gjæringen foregår gjennom en vital kraft som er tilstede i muggcellen, som han kalte "gjæringer", som ikke mister sin effektivitet med muggcellens død.
I 1878 Wilhelm Friedrich Kühne innført dagens neoklassisk vilkårlig ord enzym ( gammel gresk ἔνζυμον énzymon), avledet fra ἐν- no-, "i-", og ζύμη Zyme, noe som også betyr "surdeig" eller " gjær " [2- ] Betydningen er derfor "det som finnes i surdeig / gjær" (nemlig stoffet som utløser eller påvirker gjæring ). Dette begrepet fant da veien til internasjonal vitenskap og er nå også en del av det moderne greske språket . [3]
Kühne differensierte begrepet enzymer , som brukes til å beskrive biokatalysatorer som er effektive utenfor levende celler, fra gjæringer som etter Pasteurs oppfatning bare kunne utvikle effekten i levende celler. [4]
Emil Fischers undersøkelser av enzymspesifisitet representerer en ytterligere milepæl. Rundt 1890 postulerte han at enzymer og deres underlag oppfører seg som en lås og den riktige nøkkelen . I 1897 oppdaget Eduard Buchner på grunnlag av alkoholisk gjæring at enzymer også kan ha en katalytisk effekt uten den levende cellen; I 1907 mottok han Nobelprisen for å demonstrere cellefri gjæring. I 1903 klarte Eduard Buchner og Jakob Meisenheimer å drepe mikroorganismer som utløste fermentering av melkesyre og eddiksyre uten å påvirke enzymvirkningen. [1] Den tyske kjemikeren Otto Röhm isolerte enzymer for første gang i 1908 og utviklet prosesser for enzymatisk skinnbruning , fruktjuice -rengjøring og en rekke diagnostiske applikasjoner.
På begynnelsen av 1900 -tallet var den kjemiske sammensetningen av enzymer fremdeles ukjent. Det ble antydet at enzymer består av protein og at deres enzymatiske aktivitet er forbundet med strukturen. Andre forskere som Richard Willstätter hevdet imidlertid at proteiner bare er bærere av de "virkelige enzymer" og at de ikke er i stand til å starte en katalytisk reaksjon på egen hånd. James B. Sumner viste i 1926 at enzymet urease er et rent protein og var i stand til å krystallisere det. Den siste tvilen om sammensetningen av enzymer ble fjernet av John H. Northop og Wendell M. Stanley da de i 1930 demonstrerte at pepsin , trypsin og kymotrypsin består av rent protein. Northrop og Stanley mottok nobelprisen i kjemi for dette i 1946. [5]
Kunnskapen om hvordan man krystalliserer enzymer har nå gjort det mulig for forskerne å bruke krystallstrukturanalyse for å tydeliggjøre strukturen og funksjonen til enzymer på atomnivå. I årene 1930 til 1939 ble krystallstrukturene til elleve andre enzymer avslørt. [1] Den første aminosyresekvensen som ble fullstendig dechiffrert av et enzym er ribonukleasens . Dette trinnet ble oppnådd av Stanford Moore og William Howard Stein . I 1969 syntetiserte Robert Bruce Merrifield deretter hele sekvensen av ribonukleasen ved å bruke teknikken oppkalt etter ham ( Merrifield -syntese ). Samtidig klarte også RG Denkewalter og R. Hirschmann å gjøre dette. [1]
På 1980-tallet oppdaget Richard Lerner katalytiske antistoffer som viste enzymaktivitet etter immunisering mot et molekyl av overgangstilstand . [6] [7] Linus Pauling hadde allerede i 1948 mistanke om at enzymer binder molekyler som ligner overgangstilstanden spesielt godt. [8] På slutten av 1980 -tallet ble det oppdaget at RNA også kan utvikle katalytisk (enzymatisk) aktivitet i organismen ( ribozym ). I 1994 ble det første deoksyribozymet, GR-5 , utviklet. [9]
Forskere som Leonor Michaelis og Maud Menten var banebrytende for studiet av enzymkinetikk med formuleringen av Michaelis-Menten-teorien .
Nomenklatur og klassifisering i henhold til IUPAC og IUBMB
nomenklatur
Den IUPAC og IUBMB har sluttet en såkalt nomenklatur utviklet enzymer som disse homogene og tallrike inneholdende gruppe av representanter molekyler klassifisert . For dette formålet utviklet IUPAC prinsipper for nomenklatur:
- Enzymnavn har forlengelsen (eller suffikset ) "-ase" når det aktuelle enzymet kjemiske eller organiske forbindelser skiller seg eller deler seg (for eksempel " hydrol ase n " eller " Prote ase n ") [10] eller neuverbindet (for eksempel " Oksid ase n " eller " Telomer ase ").
- Enzymnavnet er ment å være forklarende, dvs. å beskrive reaksjonen som enzymet katalyserer. (Eksempel: kolinesterase : et enzym som hydrolyserer estergruppen i kolinmolekylet .)
- Enzymnavnet bør inneholde sin klassifisering (se nedenfor). (Eksempel: kolinesterase )
I tillegg ble det utviklet et kodesystem, EC -nummersystemet, der enzymene er klassifisert under en numerisk kode som består av fire tall. Det første tallet indikerer en av de syv enzymklassene. Lister over alle påviste enzymer sikrer at den spesifiserte enzymkoden kan bli funnet raskere, f.eks. B. på BRENDA . Selv om kodene er basert på egenskapene til reaksjonen som enzymet katalyserer, viser numeriske koder seg i praksis å være uhåndterlige. Systematiske navn basert på reglene ovenfor brukes oftere. Problemer med nomenklatur oppstår for eksempel med enzymer som katalyserer flere reaksjoner. Derfor er det noen ganger flere navn på dem. Noen enzymer har trivielle navn som ikke indikerer at stoffet som er nevnt er et enzym. Siden navnene tradisjonelt ble mye brukt, ble de delvis beholdt (eksempler: fordøyelsesenzymer trypsin og pepsin hos mennesker).
klassifisering
Enzymer er delt inn i syv enzymklasser i henhold til reaksjonen de katalyserer:
- EC 1: Oksidoreduktaser som katalyserer redoksreaksjoner .
- EC 2: Transferaser som overfører funksjonelle grupper fra ett substrat til et annet.
- EC 3: hydrolaser som spalter bindinger ved hjelp av vann .
- EC 4: Lyaser som katalyserer spaltning eller syntese av mer komplekse produkter fra enkle underlag, men uten forbruk av adenosintrifosfat (ATP) eller et annet nukleosidtrifosfat (NTP).
- EC 5: isomeraser som akselererer omdannelsen av kjemiske isomerer .
- EC 6: Ligaser eller syntetaser som katalyserer addisjonsreaksjoner ved hjelp av ATP (eller annen NTP). [11] En omvendt reaksjon (splitting) er vanligvis energisk ugunstig og finner ikke sted.
- EC 7: Translocases , transport av stoffer til eller gjennom cellemembraner. [12]
Noen enzymer er i stand til å katalysere flere, noen ganger veldig forskjellige, reaksjoner. Hvis dette er tilfellet, er de tildelt flere enzymklasser.
konstruksjon
Enzymer kan differensieres ut fra strukturen. Mens mange enzymer bare består av en polypeptidkjede , består såkalte monomerer , andre enzymer, oligomerer , av flere underenheter / proteinkjeder. Noen enzymer kombineres med andre enzymer for å danne såkalte multi- enzymkomplekser og samarbeider eller regulerer hverandre. Motsatt er det også individuelle proteinkjeder som kan utøve flere forskjellige enzymaktiviteter ( multifunksjonelle enzymer ). En annen mulig klassifisering med hensyn til strukturen tar hensyn til tilstedeværelsen av kofaktorer :
- Rene proteinenzymer består utelukkende av proteiner. Det aktive senteret dannes bare av aminosyrerester og peptid -ryggraden. Denne gruppen inkluderer for eksempel fordøyelsesenzymet chymotrypsin og triose fosfatisomerase (TIM) av glykolyse .
- Holoenzymer ( gamle Gr . Ὅλος holos "hel", "komplett" og enzym) består av en proteinkomponent, apoenzymet og en kofaktor, et lavmolekylært molekyl (uten protein). Begge sammen er viktige for enzymets funksjon. Organiske molekyler som kofaktorer kalles koenzymer . Hvis de er kovalent bundet til apoenzymet, kalles de prostetiske grupper , idet de ellers også kalt ko-substrat , siden de er reagert med substratet i ekvivalente mengder i løpet av den enzymatiske reaksjonen. Eksempler på cosubstrater er adenosintrifosfat (ATP) og nikotinamid -adenindinukleotid (NAD). ATP brukes ofte som energikilde for proteinkinaser å reagere. NAD brukes som en elektronakseptor av enzymer som alkoholdehydrogenase . Hvis et enzym som krever metallioner ( jern , sink eller kobber- ioner), er det som kalles en metalloenzyme . For eksempel inneholder lipoksygenase jern og karbonanhydrase inneholder sink.
Protein-RNA-kompleksene eller protein-ribozymkompleksene danner en spesiell gruppe, eksempler på disse er telomeraser . Ribosomene er også slike komplekser.
funksjon
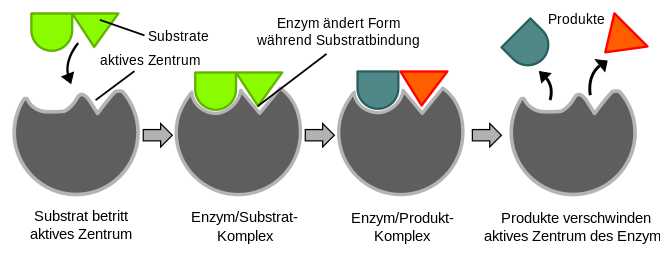
Enzymer er biokatalysatorer . De fremskynder biokjemiske reaksjoner ved å redusere aktiveringsenergien som må overvinnes for at et stoff skal omdannes. Dette øker reaksjonshastigheten (se teori om overgangstilstand ). Teoretisk sett er en enzymatisk omdannelse reversibel, dvs. produktene kan omdannes tilbake til utgangsmaterialene. Utgangsmaterialene (utgangsmaterialene) til en enzymreaksjon, substratene , er bundet i det såkalte aktive sentrum av enzymet, et enzym-substratkompleks dannes . Enzymet gjør det nå mulig å konvertere substratene til reaksjonsproduktene, som deretter frigjøres fra komplekset. Som alle katalysatorer er enzymet tilbake i sin opprinnelige form etter reaksjonen. Enzymer er preget av høyt substrat og reaksjonsspesifisitet ; fra mange stoffer velger de bare de riktige substratene og katalyserer nøyaktig en av mange tenkelige reaksjoner.
Energiske grunnlag for katalyse
De fleste biokjemiske reaksjonene ville bare skje med en ubetydelig hastighet uten enzymer i levende ting. Som med enhver spontan reaksjon, reaksjonens frie entalpi ( ) være negativ. Enzymet akselererer etableringen av den kjemiske likevekten - uten å endre den. Den enzymets katalytiske effektivitet er utelukkende basert på dets evne til å generere aktiveringsenergien i en kjemisk reaksjon å senke: dette er mengden energi som først må investeres for å sette reaksjonen i gang. I løpet av dette endres substratet stadig mer, det vedtar en energisk ugunstig overgangstilstand . Aktiveringsenergien er nå mengden energi som kreves for å tvinge substratet inn i overgangstilstanden. Det er her den katalytiske effekten av enzymet kommer inn: gjennom ikke-kovalente interaksjoner med overgangstilstanden stabiliserer den det slik at det kreves mindre energi for å bringe substratet i overgangstilstanden. Substratet kan omdannes til reaksjonsproduktet mye raskere, ettersom en måte er "asfaltert" for det, for å si det sånn.
Det aktive senteret - strukturelt grunnlag for katalyse og spesifisitet
Det aktive senteret (katalytisk senter) er ansvarlig for den enzymets katalytiske effektivitet. På dette tidspunktet binder det substratet og blir deretter "aktivt" omdannet. Det aktive senteret består av brettede deler av polypeptidkjeden eller reaktive ikke-proteindeler (kofaktorer, protetiske grupper) av enzymmolekylet og forårsaker en spesifisitet for den enzymatiske katalysen. Denne spesifisiteten er basert på komplementariteten til den romlige strukturen og de mulige overfladiske interaksjonene mellom enzym og substrat. Et enzym-substratkompleks dannes .
Den romlige strukturen til det aktive senteret betyr at bare et strukturelt egnet substrat kan bindes. Illustrativt passer et bestemt substrat til det tilsvarende enzymet som en nøkkel i den passende låsen ( nøkkel-lås-prinsippet ). Dette er grunnen til den høye substratspesifisiteten til enzymer. I tillegg til lås-og-nøkkel-modellen, er det også den ikke-stive induserte passformsmodellen : Siden enzymer er fleksible strukturer, kan det aktive senteret omformes gjennom interaksjon med underlaget.
Selv små strukturelle forskjeller i den romlige strukturen eller ladningsfordelingen til enzymet kan bety at et stoff som ligner på substratet ikke lenger blir gjenkjent som et substrat. Glukokinase, for eksempel, godtar glukose som et substrat, men stereoisomeren, galaktose , gjør det ikke. Enzymer kan ha forskjellige substratspesifisiteter, så alkoholdehydrogenaser bryter ned andre alkoholer i tillegg til etanol og heksokinase IV godtar ikke bare glukose, men også andre heksoser som substrater.
Substratet blir gjenkjent og bundet av ikke-kovalente interaksjoner ( hydrogenbindinger , elektrostatiske interaksjoner eller hydrofobe effekter ) mellom deler av enzymet og substratet. Bindingen av enzymet må være sterk nok til å binde det ofte dårlig konsentrerte substratet (mikro- til millimolære konsentrasjoner), men det må ikke være for sterkt, siden reaksjonen ikke ender med bindingen av substratet. En enda sterkere binding av reaksjonens overgangstilstand og dermed dens stabilisering er viktig. Det er ikke uvanlig at to underlag deltar i en reaksjon; enzymet må da garantere riktig orientering av reaksjonspartnerne til hverandre. Disse sistnevnte mekanistiske særtrekkene ved en enzymatisk reaksjon er grunnlaget for spesifisiteten til et enzyms virkning . Det katalyserer alltid bare en av mange mulige reaksjoner av substratene. Aktiviteten til enzymer er delvis regulert av pseudoenzymer (varianter av enzymer uten enzymaktivitet).
Katalytiske mekanismer
Selv om de detaljerte mekanismene for enzymatiske reaksjoner er varierte, bruker enzymer vanligvis en eller flere av de følgende katalytiske mekanismene.
- Foretrukket binding av overgangstilstanden
- Bindingen av overgangstilstanden er sterkere enn bindingen av substrater og produkter, noe som resulterer i en stabilisering av overgangstilstanden.
- Orientering og tilnærming av underlag
- Bindingen av to substrater i passende orientering og konformasjon kan øke reaksjonshastigheten betydelig, siden molekylens reaktive grupper kommer i riktig posisjon til hverandre og konformasjonene til molekylene som er gunstige for reaksjonen stabiliseres.
- Generell syrebasekatalyse
- Aminosyrerester, for eksempel av histidin, reagerer som syre eller base ved å ta opp eller frigjøre protoner ( H + ioner ) under en reaksjon.
- Kovalent katalyse
- Aminosyrerester eller koenzymer danner kovalente bindinger med et substrat og danner et kortvarig mellomprodukt . Vanligvis er nukleofile aminosyresidekjeder (for eksempel lysinsidekjeder med aminogruppe ) eller koenzymer som pyridoksalfosfat involvert i slike reaksjoner.
- Metallionkatalyse
- Metallioner kan støtte katalyse som strukturstabiliserende sentraler , redoks partnere (ofte jern eller kobber -ioner) eller som Lewis-syrer (ofte sink- ioner). De kan stabilisere eller skjerme negative ladninger eller aktivere vannmolekyler.
Enzymkinetikk
Enzymkinetikk omhandler forløpet av enzymatiske reaksjoner over tid. Reaksjonshastigheten er en nøkkelfaktor her. Det er et mål på endringen i substratkonsentrasjonen over tid, dvs. for mengden av substrat som omdannes til et bestemt reaksjonsvolum per tidsenhet (enhet: mol / (l · s)). I tillegg til reaksjonsbetingelsene som temperatur , saltkonsentrasjon og pH -verdi for løsningen, er det avhengig av konsentrasjonene av enzymet, substratene og produktene samt effektorer (aktivatorer eller hemmere).
Enzymaktiviteten er relatert til reaksjonshastigheten. Det indikerer hvor mye aktivt enzym det er i et enzympreparat. Enhetene for enzymaktivitet er enhet (U) og katal (kat), hvor 1 U er definert som mengden enzym som omdanner en mikromol substrat per minutt under de angitte forholdene: 1 U = 1 μmol / min. Katal brukes sjelden, men er SI -enheten for enzymaktivitet: 1 kat = 1 mol / s. En annen viktig målestokk for enzymer er den spesifikke aktiviteten (aktivitet per masseenhet, U / mg). Dette viser hvor mye av det totale proteinet i løsningen som egentlig er enzymet du leter etter.
Den målte enzymaktiviteten er proporsjonal med reaksjonshastigheten og er derfor sterkt avhengig av reaksjonsbetingelsene. Den stiger med temperaturen i henhold til RGT -regelen : en temperaturøkning med ca 5–10 ° C fører til en dobling av reaksjonshastigheten og dermed også aktiviteten. Dette gjelder imidlertid bare for et begrenset temperaturområde. Hvis en optimal temperatur overskrides, er det en kraftig nedgang i aktiviteten på grunn av denaturering av enzymet. Endringer i pH i løsningen har ofte dramatiske effekter på enzymaktiviteten, da dette kan påvirke ladningen av individuelle aminosyrer i enzymet som er viktige for katalyse. Utover den optimale pH synker enzymaktiviteten og stopper på et tidspunkt. Det samme gjelder saltkonsentrasjonen eller ionestyrken i miljøet.
Michaelis-Menten teori
En modell for den kinetiske beskrivelsen av enkle enzymreaksjoner er Michaelis-Menten-teorien (MM-teorien). Det gir et forhold mellom reaksjonshastigheten v av en enzymreaksjon og enzym- og substratkonsentrasjonen [E 0 ] og [S] . Grunnlaget er antagelsen om at et enzym danner et enzym-substratkompleks med et substratmolekyl, og dette brytes enten ned i enzym og produkt eller i dets startkomponenter. Hva som skjer raskere, avhenger av den respektive hastighetskonstanten k .
Modellen sier at jo høyere substratkonsentrasjon, desto høyere reaksjonshastighet. Dette skjer lineært i begynnelsen og flater deretter ut til en ytterligere økning i substratkonsentrasjonen ikke lenger har noen innflytelse på enzymets hastighet, siden det allerede arbeider med maksimal hastighet V max . MM -ligningen er som følger:
Parametrene K m ( Michaelis konstant ) og k cat ( omsetningstall ) er egnet for å karakterisere enzymer kinetisk, dvs. for å komme med uttalelser om deres katalytiske effektivitet . Hvis K m for eksempel er veldig lav, betyr dette at enzymet når sin maksimale hastighet selv ved en lav substratkonsentrasjon og dermed fungerer veldig effektivt. Ved lave substratkonsentrasjoner er spesifisitetskonstanten k cat / K m et mer egnet mål på den katalytiske effektiviteten. Hvis den når verdier på mer enn 10 8 til 10 9 M −1 s −1 , er reaksjonshastigheten bare begrenset av diffusjon av substrat og enzymmolekyler. Hver tilfeldig kontakt mellom enzymet og substratet fører til en reaksjon. Enzymer som oppnår dette effektivitetsnivået kalles "katalytisk perfekt".
Samarbeid og allostering
Noen enzymer viser ikke den hyperbolske metningskurven som forutsagt av Michaelis-Menten-teorien, men snarere en sigmoid metningsatferd. En slik ting var først med bindingsproteiner som hemoglobin beskrevet og som positiv kooperativitet tolket flere bindingssteder : bindingen av en ligand (substratmolekyl) påvirket flere bindingssteder i det samme enzymet (ofte men i andre underenheter ) i deres affinitet . Ved positiv kooperativitet har et bindingsprotein med mange frie bindingssteder en svakere affinitet enn et stort sett okkupert protein. Hvis den samme liganden binder seg til alle bindingssentre, snakker man om en homotrop effekt . I enzymer er kooperativitet nært knyttet til allostery . Allostery forstås å bety tilstedeværelsen av andre bindingssteder (allosteriske sentre) i et enzym, bortsett fra det aktive senteret. Hvis effektorer (ikke substratmolekyler) binder seg til allosteriske sentre, er det en heterotrop effekt . Allostery kan konseptuelt differensieres fra kooperativitet, men de forekommer ofte sammen.
Multisubstratreaksjoner
De tidligere betraktningene gjelder bare reaksjoner der et substrat omdannes til et produkt. Imidlertid katalyserer mange enzymer reaksjonen av to eller flere substrater eller ko-substrater. Flere produkter kan også lages. Ved reversible reaksjoner er skillet mellom substrat og produkt uansett relativt. Michaelis-Menten-teorien gjelder bare et av flere substrater hvis enzymet er mettet med de andre substratene.
Für Mehrsubstrat-Reaktionen sind folgende Mechanismen vorstellbar:
- Sequenzieller Mechanismus
- Die Substrate binden nacheinander an das Enzym. Haben alle Substrate gebunden, liegt ein zentraler Komplex vor. In diesem findet die Umwandlung der Substrate zu den Produkten statt, welche anschließend der Reihe nach aus dem Komplex entlassen werden. Man unterscheidet dabei zwischen:
- Zufalls-Mechanismus (engl. random ): Die Reihenfolge der Substratbindung ist zufällig.
- Geordneter Mechanismus (engl. ordered ): Die Reihenfolge der Bindung ist festgelegt.
- Ping-Pong-Mechanismus
- Die Bindung von Substrat und die Freisetzung von Produkt erfolgen abwechselnd. Erst bindet Substrat A an das Enzym und wird als erstes Produkt P abgespalten. Dabei wird das Enzym modifiziert. Dann wird das zweite Substrat B aufgenommen und reagiert zu einem zweiten Produkt Q. Das Enzym hat wieder seine Ausgangsgestalt.
Enzymhemmung

Als Enzymhemmung (Inhibition) bezeichnet man die Herabsetzung der katalytischen Aktivität eines Enzyms durch einen spezifischen Hemmstoff ( Inhibitor ). Grundlegend unterscheidet man die irreversible Hemmung , bei der ein Inhibitor eine unter physiologischen Bedingungen nicht umkehrbare Verbindung mit dem Enzym eingeht (so wie Penicillin mit der D-Alanin-Transpeptidase ), von der reversiblen Hemmung , bei der der gebildete Enzym-Inhibitor-Komplex wieder in seine Bestandteile zerfallen kann. Bei der reversiblen Hemmung unterscheidet man wiederum zwischen
- kompetitiver Hemmung – das Substrat konkurriert mit dem Inhibitor um die Bindung an das aktive Zentrum des Enzyms. Der Inhibitor ist aber nicht enzymatisch umsetzbar und stoppt dadurch die Enzymarbeit, indem er das aktive Zentrum blockiert;
- allosterische Hemmung (auch nicht-kompetitive Hemmung ) – der Inhibitor bindet am allosterischen Zentrum und verändert dadurch die Konformation des aktiven Zentrums, sodass das Substrat dort nicht mehr binden kann;
- unkompetitive Hemmung – der Inhibitor bindet an den Enzym-Substrat-Komplex und verhindert dadurch die katalytische Umsetzung des Substrates zum Produkt.
- Endprodukthemmung – das Endprodukt einer Reihe von enzymatischen Umsetzungen blockiert das Enzym 1 und beendet so die Umwandlung des Ausgangssubstrates in das Produkt. [14] Diese negative Rückkopplung sorgt bei einigen Stoffwechselprozessen für mengenmäßige Begrenzung der Produktion.
Regulation und Kontrolle der Enzymaktivität im Organismus
Enzyme wirken im lebenden Organismus in einem komplexen Geflecht von Stoffwechselwegen zusammen. Um sich schwankenden inneren und äußeren Bedingungen optimal anpassen zu können, ist eine feine Regulation und Kontrolle des Stoffwechsels und der zugrundeliegenden Enzyme nötig. Unter Regulation versteht man Vorgänge, die der Aufrechterhaltung stabiler innerer Bedingungen bei wechselnden Umweltbedingungen ( Homöostase ) dienen. Als Kontrolle bezeichnet man Veränderungen, die auf Grund von externen Signalen (beispielsweise durch Hormone) stattfinden. Es gibt schnelle/kurzfristige, mittelfristige sowie langsame/langfristige Regulations- und Kontrollvorgänge im Stoffwechsel:
Kurzfristige Anpassung
Schnelle Veränderungen der Enzymaktivität erfolgen als direkte Antwort der Enzyme auf veränderte Konzentrationen von Stoffwechselprodukten, wie Substrate, Produkte oder Effektoren (Aktivatoren und Inhibitoren). Enzymreaktionen, die nahe am Gleichgewicht liegen, reagieren empfindlich auf Veränderungen der Substrat- und Produktkonzentrationen. Anhäufung von Substrat beschleunigt die Hinreaktion , Anhäufung von Produkt hemmt die Hinreaktion und fördert die Rückreaktion (kompetitive Produkthemmung) . Allgemein wird aber den irreversiblen Enzymreaktionen eine größere Rolle bei der Stoffwechselregulation und Kontrolle zugeschrieben.
Von großer Bedeutung ist die allosterische Modulation . Substrat- oder Effektormoleküle, die im Stoffwechsel anfallen, binden an allosterische Zentren des Enzyms und verändern seine katalytische Aktivität. Allosterische Enzyme bestehen aus mehreren Untereinheiten (entweder aus gleichen oder auch aus verschiedenen Proteinmolekülen). Die Bindung von Substrat- oder Hemmstoff-Molekülen an eine Untereinheit führt zu Konformationsänderungen im gesamten Enzym, welche die Affinität der übrigen Bindungsstellen für das Substrat verändern. Eine Endprodukt-Hemmung ( Feedback-Hemmung ) entsteht, wenn das Produkt einer Reaktionskette auf das Enzym am Anfang dieser Kette allosterisch hemmend wirkt. Dadurch entsteht automatisch ein Regelkreis .
Mittelfristige Anpassung
Eine häufige Form der Stoffwechselkontrolle ist die kovalente Modifikation von Enzymen, besonders die Phosphorylierung . Wie durch einen molekularen Schalter kann das Enzym beispielsweise nach einem hormonellen Signal durch phosphat-übertragende Enzyme ( Kinasen ) ein- oder ausgeschaltet werden. Die Einführung einer negativ geladenen Phosphatgruppe zieht strukturelle Änderungen im Enzym nach sich und kann prinzipiell aktive als auch inaktive Konformationen begünstigen. Die Abspaltung der Phosphatgruppe durch Phosphatasen kehrt diesen Vorgang um, so dass eine flexible Anpassung des Stoffwechsels an wechselnde physiologische Anforderungen möglich ist.
Langfristige Anpassung
Als langfristige Reaktion auf geänderte Anforderungen an den Stoffwechsel werden Enzyme gezielt abgebaut oder neugebildet. Die Neubildung von Enzymen wird über die Expression ihrer Gene gesteuert. Eine solche Art der genetischen Regulation bei Bakterien beschreibt das Operon-Modell von Jacob und Monod . Der kontrollierte Abbau von Enzymen in eukaryotischen Zellen kann durch Ubiquitinierung realisiert werden. Das Anheften von Polyubiquitin-Ketten an Enzyme, katalysiert durch spezifische Ubiquitin-Ligasen, markiert diese für den Abbau im Proteasom , einem „Müllschlucker“ der Zelle.
Biologische Bedeutung
Enzyme haben eine hohe biologische Bedeutung, sie spielen die zentrale Rolle im Stoffwechsel aller lebenden Organismen. Nahezu jede biochemische Reaktion wird von Enzymen bewerkstelligt und kontrolliert. Bekannte Beispiele sind Glycolyse und Citrat-Zyklus , Atmungskette und Photosynthese , Transkription und Translation sowie die DNA-Replikation . Enzyme wirken nicht nur als Katalysatoren, sie sind auch wichtige Regulations- und Kontrollpunkte im Stoffwechselgeschehen.
Die Bedeutung der Enzyme beschränkt sich jedoch nicht auf den Stoffwechsel, auch bei der Reizaufnahme und -weitergabe sind sie wichtig. An der Signaltransduktion , also der Vermittlung einer Information innerhalb einer Zelle, sind häufig Rezeptoren mit enzymatischer Funktion beteiligt. Auch Kinasen , wie die Tyrosinkinasen und Phosphatasen spielen bei der Weitergabe von Signalen eine entscheidende Rolle. Die Aktivierung und Deaktivierung der Träger der Information, also der Hormone , geschehen durch Enzyme.
Weiterhin sind Enzyme an der Verteidigung des eigenen Organismus beteiligt, so sind zum Beispiel diverse Enzyme wie die Serinproteasen des Komplementsystems Teil des unspezifischen Immunsystems des Menschen.
Fehler in Enzymen können fatale Folgen haben. Durch solche Enzymdefekte ist die Aktivität eines Enzyms vermindert oder gar nicht mehr vorhanden. Manche Enzymdefekte werden genetisch vererbt, dh, das Gen , das die Aminosäuresequenz des entsprechenden Enzyms codiert, enthält eine oder mehrere Mutationen oder fehlt ganz. Beispiele für vererbbare Enzymdefekte sind die Phenylketonurie und Galaktosämie .
Artifizielle Enzyme (beispielsweise in Brot teig, die beim Backvorgang nicht denaturiert werden [15] ) bergen das Risiko, Allergien auszulösen [16]
Verwendung und Auftreten im Alltag
Enzyme sind wertvolle Werkzeuge der Biotechnologie . Ihre Einsatzmöglichkeiten reichen von der Käseherstellung ( Labferment ) über die Enzymatik bis hin zur Gentechnik . Für bestimmte Anwendungen entwickeln Wissenschaftler heute gezielt leistungsfähigere Enzyme durch Protein-Engineering . Zudem konstruierte man eine neuartige Form katalytisch aktiver Proteine, die katalytischen Antikörper , die aufgrund ihrer Ähnlichkeit zu den Enzymen Abzyme genannt wurden. Auch Ribonukleinsäuren (RNA) können katalytisch aktiv sein; diese werden dann als Ribozyme bezeichnet.
Enzyme werden unter anderem in der Industrie benötigt. Waschmitteln und Geschirrspülmitteln fügt man Lipasen (Fett spaltende Enzyme), Proteasen ( Eiweiß spaltende Enzyme) und Amylasen ( Stärke spaltende Enzyme) zur Erhöhung der Reinigungsleistung hinzu, weil diese Enzyme die entsprechenden Flecken in Kleidung oder Speisereste am Geschirr zersetzen.
Enzyme werden auch zur Herstellung einiger Medikamente und Insektenschutzmittel verwendet. Bei der Käseherstellung wirkt das Labferment mit, ein Enzym, das aus Kälbermägen gewonnen wurde.
Viele Enzyme können heute mit Hilfe von gentechnisch veränderten Mikroorganismen hergestellt werden.
Die in rohen Ananas , Kiwifrüchten und Papayas enthaltenen Enzyme verhindern das Erstarren von Torten gelatine , ein unerwünschter Effekt, wenn beispielsweise ein Obstkuchen , der rohe Stücke dieser Früchte enthält, mit einem festen Tortengelatinebelag überzogen werden soll. Das Weichbleiben des Übergusses tritt nicht bei der Verwendung von Früchten aus Konservendosen auf, diese werden pasteurisiert , wobei die eiweißabbauenden Enzyme deaktiviert werden. [17]
Beim Schälen von Obst und Gemüse werden pflanzliche Zellen verletzt und in der Folge Enzyme freigesetzt. Dadurch kann das geschälte Gut (bei Äpfeln und Avocados gut ersichtlich) durch enzymatisch unterstützte Reaktion von Flavonoiden oder anderen empfindlichen Inhaltsstoffen mit Luftsauerstoff braun werden. Ein Zusatz von Zitronensaft wirkt dabei als Gegenmittel. Die im Zitronensaft enthaltene Ascorbinsäure verhindert die Oxidation oder reduziert bereits oxidierte Verbindungen (Zusatz von Ascorbinsäure als Lebensmittelzusatzstoff ).
In der Medizin spielen Enzyme eine wichtige Rolle. Viele Arzneimittel hemmen Enzyme oder verstärken ihre Wirkung, um eine Krankheit zu heilen. Prominentester Vertreter solcher Arzneistoffe ist wohl die Acetylsalicylsäure , die das Enzym Cyclooxygenase hemmt und somit unter anderem schmerzlindernd wirkt.
Enzyme in der Technik
Die folgende Tabelle gibt einen Überblick über die Einsatzgebiete von Enzymen. Zur Herstellung siehe Protein .
| technischer Prozess | Enzyme | Wirkung |
|---|---|---|
| Stärkeverarbeitung | α- Amylase , Glucoamylase | Stärkehydrolyse |
| Racematspaltung | L- Acylase | Herstellung von Aminosäuren |
| Waschmittel | Proteasen , Lipasen | Hydrolyse von Eiweißen , Fetten |
| Käseproduktion | Proteasen | Milchgerinnung |
| Brennerei -Produkte | α-Amylase, Glucoamylase | Stärkeverzuckerung |
| Brauereiindustrie | α-Amylase, Glucoamylase, Proteasen | Maischprozess |
| Fruchtsaftverarbeitung | Pektinasen , α-Amylase | Hydrolyse der Pektine bzw. von Stärke |
| Backwarenherstellung | α-Amylase, Proteasen, Pentosanase | teilweise Hydrolyse von Mehl- und Teiginhaltsstoffen |
| Lederverarbeitung | Proteasen | Weichen, Enthaaren von Leder |
| Textilindustrie | α-Amylase | Stärkehydrolyse, Entschlichten |
Einsatz von Enzymen für Plastikrecycling
Enzyme kommen auch für das Recycling von Plastik zum Einsatz. Diese müssen ausreichend hitzestabil sein, dh, sie müssen Temperaturen um die 70 Grad aushalten. [18] Die französische Firma Carbios hat ein Enzym gefunden, das Polyethylenterephthalat (PET) in seine Monomere ( Ethylenglycol und Terephthalsäure ) zerlegt. Die Flaschen müssen vor dem Erhitzen zuerst verkleinert werden. Am Ende des Prozesses steht ein Plastikgranulat, das für neue PET-Produkte verwendet werden kann. [19] Trotz des relativ hohen Aufwands wird das Verfahren als lohnend bewertet, da die Ausgaben sich nur auf etwa 4 % der Kosten belaufen, die für die Produktion neuer Plastikflaschen aus Rohöl anfallen. [20] [21]
Bedeutung von Enzymen in der medizinischen Diagnostik
Die Diagnostik verwendet Enzyme, um Krankheiten zu entdecken. In den Teststreifen für Diabetiker befindet sich zum Beispiel ein Enzymsystem, das unter Einwirkung von Blutzucker einen Stoff produziert, dessen Gehalt gemessen werden kann. So wird indirekt der Blutzuckerspiegel gemessen. Man nennt diese Vorgehensweise eine „enzymatische Messung“. Sie wird auch in medizinischen Laboratorien angewandt, zur Bestimmung von Glucose (Blutzucker) oder Alkohol. Enzymatische Messungen sind relativ einfach und preisgünstig anzuwenden. Man macht sich dabei die Substratspezifität von Enzymen zu Nutze. Es wird also der zu analysierenden Körperflüssigkeit ein Enzym zugesetzt, welches das zu messende Substrat spezifisch umsetzen kann. An der entstandenen Menge von Reaktionsprodukten kann man dann ablesen, wie viel des Substrats in der Körperflüssigkeit vorhanden war.
Im menschlichen Blut sind auch eine Reihe von Enzymen anhand ihrer Aktivität direkt messbar. Die im Blut zirkulierenden Enzyme entstammen teilweise spezifischen Organen. Es können daher anhand der Erniedrigung oder Erhöhung von Enzymaktivitäten im Blut Rückschlüsse auf Schädigungen bestimmter Organe gezogen werden. So kann eine Bauchspeicheldrüsenentzündung durch die stark erhöhte Aktivität der Lipase und der Pankreas-Amylase im Blut erkannt werden.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg – Berlin 2003, ISBN 3-8274-1303-6 .
- David Fell: Understanding the Control of Metabolism . Portland Press Ltd, London 1997, 2003, ISBN 1-85578-047-X .
- Alfred Schellenberger (Hrsg.): Enzymkatalyse. Einführung in die Chemie, Biochemie und Technologie der Enzyme . Gustav Fischer Verlag, Jena 1989, ISBN 3-540-18942-4 .
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage. John Wiley & Sons Inc., London 2004, ISBN 0-471-39223-5 .
- Maria-Regina Kula: Enzyme in der Technik. Chemie in unserer Zeit , 14. Jahrg. 1980, Nr. 2, S. 61–70, doi:10.1002/ciuz.19800140205
- Brigitte Osterath, Nagaraj Rao, Stephan Lütz, Andreas Liese: Technische Anwendung von Enzymen: Weiße Wäsche und Grüne Chemie. Chemie in unserer Zeit 41(4), S. 324–333 (2007), doi:10.1002/ciuz.200700412
- Otto Westphal , Theodor Wieland , Heinrich Huebschmann: Lebensregler. Von Hormonen, Vitaminen, Fermenten und anderen Wirkstoffen. Societäts-Verlag, Frankfurt am Main 1941 (= Frankfurter Bücher. Forschung und Leben. Band 1), insbesondere S. 57–64 ( Geschichte der Fermentforschung ).
Weblinks
- IUBMB – Verzeichnis und Nomenklatur der Enzyme
- BRENDA umfangreiche Enzymdatenbank
- ExploreEnz – The Enzyme Database
- Enzymdatenbank mit Suchmaschine
- KEGG Metabolic Pathway Database (graphische Darstellungen der biochemischen Reaktionen mit den dazugehörigen, systematisch identifizierten Enzymen)
- Auswahl von Enzymen, die Brotteig zugesetzt werden
Einzelnachweise
- ↑ a b c d e f Wolf-Dieter Müller-Jahncke , Christoph Friedrich , Ulrich Meyer: Arzneimittelgeschichte . 2., überarbeitete und erweiterte Auflage. Wissenschaftliche Verlagsgesellschaft mbH, Stuttgart 2005, ISBN 978-3-8047-2113-5 , S. 106 .
- ↑ a b Kluge Etymologisches Wörterbuch der deutschen Sprache, 24. Auflage.
- ↑ Dictionary bei in.gr, Eintrag Enzyme. Abgerufen am 29. Mai 2013.
- ↑ Wolf-Dieter Müller-Jahncke : Enzyme. In: Werner E. Gerabek , Bernhard D. Haage, Gundolf Keil , Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin/ New York 2005, ISBN 3-11-015714-4 , S. 356 f., hier: S. 356.
- ↑ The Nobel Prize in Chemistry 1946. In: nobelprize.org , abgerufen am 19. November 2016.
- ↑ A. Tramontano, KD Janda, RA Lerner: Catalytic antibodies. In: Science. Band 234, Nummer 4783, Dezember 1986, S. 1566–1570. PMID 3787261 .
- ↑ RA Lerner, SJ Benkovic, PG Schultz: At the crossroads of chemistry and immunology: catalytic antibodies. In: Science. Band 252, Nummer 5006, Mai 1991, S. 659–667. PMID 2024118 .
- ↑ L. Pauling: Chemical achievement and hope for the future. In: American scientist. Band 36, Nummer 1, Januar 1948, S. 51–58. PMID 18920436 .
- ↑ Ronald R. Breaker, Gerald F. Joyce: A DNA enzyme that cleaves RNA . In: Chem Biol. Band 1 , Nr. 4 , Dezember 1994, S. 223–229 , doi : 10.1016/1074-5521(94)90014-0 , PMID 9383394 .
- ↑ -ase – Duden , 2016
- ↑ JCBN/NC-IUB Newsletter 1984: Synthases and Ligases (englisch).
- ↑ Nomenclature Committee of the International Union of Biochemistry and Molecular Biology (NC-IUBMB) Enzyme Nomenclature. Recommendations: EC 7. Translocases (englisch)
- ↑ Archivierte Kopie ( Memento des Originals vom 24. Februar 2016 im Internet Archive ) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- ↑ Ulrich Weber (Hrsg.): Biologie Oberstufe Gesamtband, Cornelsen Verlag Berlin 2001, ISBN 3-464-04279-0 , S. 72.
- ↑ Funktionelle Enzyme (im Brotteig)
- ↑ Artifizielle Enzyme könnten Allergien auslösen
- ↑ Robert Ebermann, Ibrahim Elmadfa: Lehrbuch der Lebensmittelchemie und Ernährung. 2. Auflage. Springer-Verlag Wien New York, 2008 und 2011, ISBN 978-3-7091-0210-7 , S. 594, Seite online bei Google Books .
- ↑ Künstliches Enzym kann Plastik zerlegen. Deutschlandfunk Nova , abgerufen am 27. Januar 2021 .
- ↑ Mutiertes Enzym zerlegt Plastik in Rekordzeit. ingenieur.de, abgerufen am 27. Januar 2021 .
- ↑ Mutiertes Enzym zerlegt Plastik in wenigen Stunden. t-online.de , abgerufen am 27. Januar 2021 .
- ↑ Das Enzym, das Plastik frisst. Frankfurter Rundschau , abgerufen am 27. Januar 2021 .
- Wikipedia:Gesprochener Artikel
- Wikipedia:Exzellent
- Enzym
- Physiologie






![v = {k_ {cat} [E_ {0}] [S_ {0}] \ over K_ {m} + [S_ {0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8440c752cf139697cc911054213ca1a2755207cb)

