lede
| eiendommer | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
[ Xe ] 4 f 14 5 d 10 6 s 2 6 p 2
82 Pb
Periodiske tabell
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Som regel | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Navn , symbol , atomnummer | Bly, Pb, 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elementkategori | Metaller | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppe , periode , blokk | 14 , 6 , s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | Blåaktig hvit | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS -nummer |
7439-92-1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| EF -nummer | 231-100-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ECHA InfoCard | 100.028.273 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Massefraksjon av jordens konvolutt | 18 spm [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atommasse | 207,2 (1) [3] u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradius (beregnet) | 180 (154) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radius | 146 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waals radius | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfigurasjon | [ Xe ] 4 f 14 5 d 10 6 s 2 6 p 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. Ioniseringsenergi | 7. 416 679 9 (6) eV [4] ≈ 715 . 6 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. Ioniseringsenergi | 15. 032 499 (7) eV [4] ≈ 1 450. 42 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. Ioniseringsenergi | 31 . 9373 (6) eV [4] ≈ 3 081. 48 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Ioniseringsenergi | 42 . 33256 (10) eV [4] ≈ 4084. 47 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Ioniseringsenergi | 68 . 8 (5) eV [4] ≈ 6 640 kJ / mol [5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysisk tilstand | fikset | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Krystallstruktur | Kubisk områdesentrert | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| tetthet | 11,342 g / cm³ (20 ° C ) [6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hardhet | 1.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetisme | diamagnetisk ( Χ m = -1,6 · 10 −5 ) [7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smeltepunkt | 600,61 K (327,43 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| kokepunkt | 2017 K [8] (1744 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molar volum | 18,26 10 −6 m 3 mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fordampningsvarme | 177 kJ mol −1 [8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fusjonsvarme | 4,85 [9] kJ mol −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lydens hastighet | 1260 m s −1 ved 293,15 K. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Spesifikk varmekapasitet | 131 [9] J · kg −1 · K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk ledningsevne | 4,76 · 10 6 A · V −1 · m −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Termisk ledningsevne | 35 W m −1 K −1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mekanisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Poissons nummer | 0,44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kjemisk [2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidasjonstilstander | 2 , 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Normalt potensial | −0,1251 V (Pb 2+ + 2 e - → Pb) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 2,33 ( Pauling -skala ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| For andre isotoper, se listen over isotoper | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| sikkerhetsinstruksjoner | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Godkjenningsprosedyre underREACH | særlig bekymring : reproduksjonstoksisk ( CMR )[12] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toksikologiske data | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Så langt som mulig og vanlig brukes SI -enheter . Med mindre annet er angitt, gjelder dataene som gis for standardbetingelser . |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bly er et kjemisk element med elementets symbol Pb ( latinsk plumbum ) og atomnummeret 82. Det er et giftig tungmetall og er i den fjerde hovedgruppen eller den 14. IUPAC -gruppen ( karbongruppe ) og sjette periode i det periodiske systemet . Bly er lett formbart og har et relativt lavt smeltepunkt.
Isotopene 206 Pb, 207 Pb og 208 Pb er de tyngste stabile atomene, så bly er elementet med høyest masse og atomnummer som fremdeles er stabilt. Alle blyisotoper har det magiske proton nummer 82, som forårsaker denne stabiliteten. Ved 208 Pb er det til og med en såkalt dobbelt magisk kjerne fordi den også har det magiske nøytron nummer 126.
Siden blyisotopene -206, -207 og -208 er sluttproduktene i de tre naturlige forfallsseriene av radioaktive elementer, ble det dannet en relativt stor mengde bly; den er derfor vanlig i jordskorpen sammenlignet med andre tunge grunnstoffer ( kvikksølv , gull, etc.).
historie
Det eldste funnet av metallisk bly hittil ble gjort i Çatalhöyük , omtrent 50 km sørøst for Konya på Anatolian Plateau. Den består av blyperler sammen med kobberperler, som er datert til rundt 6500 f.Kr. [1. 3]
I tidlig bronsealder ble bly brukt sammen med antimon og arsen for å produsere bronse fra legeringer med kobber, til tinn ble allment akseptert. Babylonerne var allerede kjent med blyvaser. Assyrerne måtte importere bly ( abāru ), som blant annet er dokumentert av Tiglath-pileser I. som en hyllest fra Melid . [14] I det gamle Hellas ble det hovedsakelig utvunnet bly i form av galena for å utvinne sølv. [15] I Romerriket ble imidlertid materialet til en rekke bruksområder brukt. Bly var av spesiell betydning i arkitekturen, for eksempel hvor steinblokker ble festet til hverandre med blyklips. Anslagsvis syv tonn bly ble brukt til å bygge Porta Nigra . [16] Andre viktige anvendelsesområder var kledning av skipsskrog for å beskytte mot skadedyrsangrep og produksjon av vannrør i sentrum. I tillegg ble bly brukt som råvare for fremstilling av fartøyer, som materiale for skrivebrett eller for de såkalte tesserae , som for eksempel ble brukt som identifikasjons- eller autorisasjonsmerker. [17] Små blystykker, den såkalte "slynge", ble brukt som slynger i den romerske hæren. [18] På grunn av den høye etterspørselen var det også handel med bly over lange avstander, noe som blant annet kan påvises ved inskripsjoner på romerske blyguter. [17]
I gammel litteratur ble det antatt at bly og tinn var to manifestasjoner av det samme stoffet, slik at bly på latin ble omtalt som plumbum nigrum (fra niger 'svart' ) og tinn som plumbum candidum (fra candidus 'hvitt' ). Det er derfor ofte uklart om en gammel tekst med plumbum betyr bly eller tinn. [15] Selv den romerske forfatteren Vitruvius anså bruk av bly for drikkevannsrør for å være helseskadelig og anbefalte å bruke leirerør i stedet hvis mulig. [19] Likevel var drikkevannsrør laget av bly i bruk fram til 1970 -tallet, noe som for eksempel også kommer til uttrykk i det engelske ordet rørlegger , 'rørlegging' . Fra dagens synspunkt var tilsetningen av bly som søtningsmiddel til vin (såkalt "bly sukker", se bly (II) acetat ) spesielt bekymringsfullt. Hyppig bruk av bly i rør og vin har også blitt diskutert som årsak til Romerrikets fall , men dette blir nå avvist i forskning. [17]
I Westfalen fikk romerne ledelsen til de trakk seg tilbake etter Varus -slaget . Sammensetningen av isotopene , som er typisk for forskjellige steder, viser at blyet for fremstilling av romerske blykister funnet i Rhinlandet kommer fra den nordlige Eifel . Den romerske blybehandlingen har ført til miljøforurensning som fortsatt kan verifiseres i dag: iskjerner fra Grønland viser mellom 500 -tallet f.Kr. F.Kr. og 300 -tallet e.Kr. en målbar økning i blyinnholdet i atmosfæren.
Bly (fra mellomhøjtysk blī ) hadde også en viktig betydning senere. Den ble for eksempel brukt til kanting av blyglassvinduer , for eksempel i kirker eller for å dekke blytak . Bly ble spesielt viktig etter oppfinnelsen av skytevåpen for militæret som materiale for prosjektiler for håndvåpen. Siden soldater laget sine egne prosjektiler, var det ikke uvanlig at de stjal det blyet de fant for å lage prosjektiler av det.
Bly spilte også en viktig rolle i alkymi . På grunn av sin likhet med gull (like mykt og tungt) ble bly ansett som et godt utgangsmateriale for gullsyntese (syntese som en fargeendring fra grått til gult). Det alkymiske symbolet for bly er en stilisert sigd (♄), ettersom det har blitt tildelt guden og planeten Saturn (latin: Saturnus ) som et planetmetall siden antikken.
Med begynnelsen av den industrielle revolusjonen , ble det deretter nødvendig med bly i store mengder for den kjemiske industrien , for eksempel for produksjon av svovelsyre i blykammerprosessen eller foring av anlegg for produksjon av eksplosiver . Det var den viktigste ikke-jernholdige metallen på den tiden.
I et forsøk på å bestemme jordens alder ved å måle forholdet mellom bly og uran i steinprøver, fant den amerikanske geokjemisten Clair Cameron Patterson rundt 1950 at steinprøvene alle var forurenset med store mengder bly fra atmosfæren. Han var i stand til å identifisere kilden til tetraetyl-blyet som ble brukt som et anti-knock-middel i drivstoff. Før 1923 fant Patterson at atmosfæren nesten ikke inneholdt bly i det hele tatt. Basert på denne kunnskapen kjempet han hele livet for å redusere utslipp av bly i miljøet. Hans innsats førte til slutt til USAs Clean Air Act fra 1970 med strengere utslippsregler som trådte i kraft. I 1986, salg av blyholdig bensin i USA, Tyskland var bensin bly lov gradvis fra 1988 [20] , EU utestengt helt fra 2001 th Som et resultat falt nivået av bly i blodet til amerikanerne med 80 prosent nesten umiddelbart. Siden bly imidlertid forblir praktisk talt for alltid i miljøet, har hver person i dag fremdeles rundt 600 ganger mer av metallet i blodet enn før 1923. Rundt år 2000 ble rundt 100 000 tonn fortsatt lovlig sluppet ut i atmosfæren hvert år. De viktigste forurenserne er gruvedrift, metallindustri og produksjon. [21]
I 2009 var mengden bly utvunnet fra ikke-jernholdige metaller fjerde etter aluminium , kobber og sink . Den brukes hovedsakelig til bilbatterier ( blyakkumulatorer ) (60% av total produksjon).[22]
Generelt forsøkes det på å redusere eksponering av mennesker og miljø for bly og dermed blyforgiftning . I tillegg til forbudet mot blyholdig bensin, ble bruken av bly i elektrisk og elektronisk utstyr begrenset fra 2002 og fremover av RoHS -direktivene . I 1989 ble maling og belegg som inneholder bly forbudt fullstendig [23] , og bruk av bly som inneholder ammunisjon ble delvis forbudt fra 2005 i noen føderale stater. [24] Som materiale for vannrør ble bly forbudt allerede i 1973, men det er fortsatt ingen bestemmelser for fjerning av blyrør fra eksisterende eiendommer, og derfor krevde det tyske forbundsrådet forbud mot drikkeholdig drikkevann rør i 2017. [25] [26] Siden 1. mars 2018 har bruken (lagring, blanding, bruk for produksjon, etc.) og markedsføring av bly - fast stoff (f.eks. Som stenger eller pellets) eller som pulver - vært lik som for mange lenge Med noen få unntak er blyforbindelser regelmessig forbudt i EU hvis de er beregnet for salg til allmennheten og blykonsentrasjonen deri er 0,3% eller mer; I tillegg må leverandøren sørge for at dette er merket som "bare for kommersielle brukere" før det slippes ut på markedet. [27]
Skje
Bly forekommer i jordskorpen med et innhold på rundt 0,0018% [28] og forekommer ganske sjelden i fast form , dvs. i elementær form. Likevel er rundt 200 steder for solid bly nå kjent over hele verden (fra 2017), for eksempel i Argentina , Etiopia , Australia , Belgia , Brasil , Folkerepublikken Kina , Tyskland , Finland , Frankrike , Georgia , Hellas , Grønland , Italia , Canada , Kasakhstan , Kirgisistan , Mexico , Mongolia , Namibia , Norge , Østerrike , Polen , Russland , Sverige , Slovenia , Tsjekkia , Ukraina , De amerikanske jomfruøyene , Storbritannia og USA (USA). [29]
Bly kan også bli funnet i steinprøver av den midtatlantiske åsryggen , nærmere bestemt ved den nordøstlige kanten av "Markov-dybden" innenfor "Sierra Leone Fracture Zone" (Sierra Leone Threshold), samt utenfor jorden på månen i Mare Fecunditatis . [29]
På hvert sted skiller den isotopiske sammensetningen seg noe fra gjennomsnittsverdiene gitt ovenfor, slik at en presis analyse av isotopkomposisjonen kan brukes til å bestemme plasseringen og, i tilfelle av arkeologiske funn, trekke konklusjoner om gamle handelsruter . I tillegg, avhengig av hvor det finnes, kan bly også inneholde forskjellige utenlandske tilsetninger som sølv, kobber, sink, jern, tinn og / eller antimon. [30]
I bly malmer, er bly for det meste til stede som galena (blysulfid PbS, bly glans). Dette mineralet er også den viktigste kommersielle kilden for utvinning av nytt bly. Andre blymineraler er cerussitt (bly (II) karbonat, PbCO 3 , også hvit blymalm ), krokokitt (bly (II) kromat, PbCrO 4 , også rød blymalm ) og vinkelsitt (bly (II) sulfat, PbSO 4 , også bly-nitrid). Blymineralene med den høyeste blykonsentrasjonen i forbindelsen er litargitt og massikotitt (opptil 92,8%) og minium (opptil 90,67%). Totalt er det kjent 514 blymineraler til dags dato (fra 2017). [31]
De økonomisk utvinnbare lagrene er anslått til 67 millioner tonn over hele verden (status 2004). [32] De største forekomstene finnes i Folkerepublikken Kina , USA , Australia , Russland og Canada . I Europa er Sverige og Polen landene med størst innskudd.
Også i Tyskland, i den nordlige Eifel (Rescheid / Gruben Wohlfahrt og Schwalenbach; Mechernich / Grube Günnersdorf og også gruvedrift / Virginia; Bleialf ), i Schwarzwald, i Harzen (Goslar / Rammelsberg ), i Sachsen ( Freiberg / Muldenhütten ), ved nedre Lahn ( Bad Ems , Holzappel ), så vel som i Westfalen ( Ramsbeck / Sauerland) tidligere blymalm utvunnet, smeltet og foredlet.
Den viktigste blykilden i dag er resirkulering av gamle blyprodukter. Derfor er det bare to primære smelteverk i Tyskland som produserer bly fra malm, Binsfeldhammer blysmelteverk i Stolberg (Rhld.) Og Metaleurop i Nordenham nær Bremerhaven . Alle andre smelteverk produserer det som kalles sekundær bly ved å behandle gammelt bly (spesielt fra brukte bilbatterier ).
Bly som mineral
Naturlige forekomster av bly i sin elementære form var kjent allerede før International Mineralogical Association (IMA) ble grunnlagt. Mangan-rik jernmalm innskudd Langban i Sverige er gitt som en antatt typen lokalitet , hvor store mengder av opp til 50 kg [33] eller 60 kg [34] er sagt å ha blitt funnet. Bly er derfor anerkjent som et såkalt bestefarlig mineral som en uavhengig type mineral. [35]
I henhold til systematikken for mineraler i henhold til Strunz (9. utgave) er bly under systemnummer 1.AA.05 (elementer - metaller og intermetalliske forbindelser - kobberkupalittfamilie - kobbergruppe) [36] eller i den utdaterte 8. utgaven klassifisert under I / A.03 ( tin-lead group ). Systematikken til mineraler ifølge Dana , som hovedsakelig brukes i engelsktalende land , viser elementet mineral under systemnr. 01/01/01/04 (gull gruppe). [37]
I naturen forekommer solid bly vanligvis i form av centimeterstore ark og plater samt granulære, dendritiske, hårformede eller trådformede aggregater . [38] Svært sjelden er det også oktaedriske , terninger og dodekedriske blykrystaller , som vanligvis er små, [39], men noen ganger kan en størrelse mellom 4 cm [33] oppnå og 6 cm. [30]
Stater med størst finansiering
| rang | land |
Leveringspriser (i 1000 t ) |
rang | land | Leveringspriser (i 1000 t) |
|---|---|---|---|---|---|
| 1 |
|
950 | 11 |
|
33,9 |
| 2 |
|
642 | 12. |
|
33 |
| 3 |
|
445 | 13. |
|
31.3 |
| 4. |
|
306.2 | 14. |
|
24 |
| 5 |
|
118,5 | 15. |
|
22. |
| 6. |
|
76,7 | 16 |
|
20. |
| 7. |
|
65,9 | 17. |
|
19. |
| 8. |
|
39,8 | 18. |
|
18.7 |
| 9 |
|
38 | 19. |
|
15. |
| 10 |
|
37,5 | 20. |
|
14.7 |
Verdens viktigste produksjonsland for blymalm i 2004 var Folkerepublikken Kina (950 000 tonn), Australia (642 000 tonn) og USA (445 000 tonn), som til sammen utgjorde rundt to tredjedeler av de 3,1 millioner tonnene som ble utvunnet over hele verden. Irland, Sverige og Polen er de største ledende produsentene i Europa.
De viktigste produsentene av raffinert bly ( metallurgisk mykt bly med 99,9% renhet) er Folkerepublikken Kina (1,8 millioner tonn), USA (1,2 millioner tonn) og Tyskland (403 000 tonn), som til sammen utgjør rundt halvparten av 6,7 millioner tonn produsert over hele verden. Andre store produsenter av raffinert bly i Europa er Storbritannia, Italia, Frankrike og Spania.
Det globale forbruket eller produksjonen av bly steg fra omtrent 7 millioner tonn til omtrent 11 millioner tonn i årene 2013 til 2016. [41] [42]
Uttrekk og presentasjon
Det desidert viktigste blymineralet er galena . Dette skjer ofte i forbindelse med sulfider av andre metaller (kobber, vismut, sink, arsen, antimon, etc.), som naturlig inneholder opptil 5% av rå bly som en urenhet.
Malmen, som er bearbeidet til et mineralinnhold på opptil 60% ved knusing, klassifisering og flotasjon , omdannes til metallisk bly i tre forskjellige industrielle prosesser. Prosessene med stekingsreduksjon og stekingsreaksjonen tar i økende grad baksetet og erstattes av direkte smelteprosesser, som på den ene siden kan gjøres mer økonomiske og på den andre siden er mer miljøvennlige.
Stekereduksjon
Denne prosessen foregår i to trinn, steking og reduksjon . Ved steking legges det finmalte blysulfidet på en rist og luft ved 1000 ° C tvinges gjennom det. Det reagerer med oksygenet i luften i en eksoterm reaksjon for å danne bly (II) oksid (PbO) og svoveldioksid . Dette tømmes via stekegassene og kan brukes til produksjon av svovelsyre . Das Bleioxid ist unter diesen Bedingungen flüssig und fließt nach unten. Dort kann es gesintert werden.
- (Röstarbeit)
Anschließend erfolgt die Reduktion des Bleioxids mit Hilfe von Koks zu metallischem Blei. Dies geschieht in einem Schachtofen, ähnlich dem beim Hochofenprozess verwendeten. Dabei werden schlackebildende Zuschlagsstoffe wie Kalk beigefügt.
- (Reduktionsarbeit)
Röstreaktionsarbeit
Dieses Verfahren kommt vor allem bei hochgradig mit PbS angereicherten Bleierzen zum Einsatz und ermöglicht die Bleierzeugung in einem Schritt. Dabei wird das sulfidische Erz nur unvollständig geröstet. Anschließend wird das Bleisulfid/Bleioxid-Gemisch weiter unter Luftabschluss erhitzt. Dabei setzt das Bleioxid sich mit dem verbliebenen PbS ohne Zugabe eines weiteren Reduktionsmittels zu Blei und Schwefeldioxid um:
- (Röstarbeit),
- (Reaktionsarbeit).
Direktschmelzverfahren
Moderne Herstellungsverfahren für Blei basieren auf Direktschmelzverfahren, die auf Umweltverträglichkeit und Wirtschaftlichkeit hin optimiert wurden (z. B. das QSL-Verfahren [43] ). Vorteilhaft ist die kontinuierliche Prozessführung mit Beschränkung auf einen Reaktionsraum, der als einziger Emittent für Schadstoffe auftritt – im Vergleich dazu weisen die klassischen Produktionsverfahren das Sintern als zusätzlichen emittierenden Schritt auf. Das Rösten und die Reduktion finden parallel in einem Reaktor statt. Das Bleisulfid wird ähnlich wie beim Röstreaktionsverfahren nicht vollständig geröstet. Ein Teil des Bleis entsteht somit durch Reaktion des Bleisulfids mit Bleioxid. Da der Reaktor leicht geneigt ist, fließen Blei und bleioxidhaltige Schlacke ab. Diese passiert die Reduktionszone, in die Kohlenstaub eingeblasen und das Bleioxid so zu Blei reduziert wird. Beim Rösten wird statt Luft reiner Sauerstoff verwendet. Dadurch verringert sich das Volumen an Abgasen erheblich, die andererseits eine im Vergleich zu konventionellen Verfahren höhere Konzentration an Schwefeldioxid aufweisen. Deren Verwendung für die Schwefelsäureherstellung gestaltet sich somit einfacher und wirtschaftlicher.
Raffination
Das entstehende Werkblei enthält 2–5 % andere Metalle, darunter Kupfer , Silber , Gold , Zinn , Antimon , Arsen , Bismut in wechselnden Anteilen. Das Aufreinigen und Vermarkten einiger dieser Beiprodukte, insbesondere des bis zu 1 % im Werkblei enthaltenen Silbers, trägt wesentlich zur Wirtschaftlichkeit der Bleigewinnung bei.
Die pyrometallische Raffination des Bleis ist ein mehrstufiger Prozess. Durch Schmelzen in Gegenwart von Natriumnitrat/Natriumcarbonat bzw. von Luft werden Antimon, Zinn und Arsen oxidiert und können als Bleiantimonate, -stannate und -arsenate von der Oberfläche der Metallschmelze abgezogen werden („Antimonabstrich“). Kupfer wie auch eventuell enthaltenes Zink, Nickel und Kobalt werden durch Seigern des Werkbleis aus dem Rohmetall entfernt. Dabei sinkt auch der Schwefelgehalt beträchtlich. Silber wird nach dem Parkes-Verfahren ggf. durch die Zugabe von Zink und das Ausseigern der sich bildenden Zn-Ag- Mischkristalle aus dem Blei abgeschieden („Parkesierung“), während die Bedeutung des älteren Pattinson-Verfahrens stark zurückgegangen ist ( siehe auch Herstellung von Silber, Blicksilber ). Bismut kann nach dem Kroll-Betterton-Verfahren durch Legieren mit Calcium und Magnesium als Bismutschaum von der Oberfläche der Bleischmelze abgezogen werden.
Eine weitere Reinigung kann durch elektrolytische Raffination erfolgen, jedoch ist dieses Verfahren bedingt durch den hohen Energiebedarf kostenintensiver. Blei ist zwar ein unedles Element, welches in der elektrochemischen Spannungsreihe ein negativeres Standardpotential als Wasserstoff aufweist. Dieser hat jedoch an Bleielektroden eine hohe Überspannung , so dass eine elektrolytische Abscheidung metallischen Bleis aus wässrigen Lösungen möglich wird, siehe elektrolytische Bleiraffination .
Raffiniertes Blei kommt als Weichblei bzw. genormtes Hüttenblei mit 99,9- bis 99,97%iger Reinheit (z. B. Eschweiler Raffiné ) oder als Feinblei mit 99,985 bis 99,99 % Blei (DIN 1719, veraltet) in den Handel. Entsprechend dem Verwendungszweck sind auch Bezeichnungen wie Kabelblei für die Legierung mit ca. 0,04 % Kupfer verbreitet. Aktuelle Normen wie DIN EN 12659 kennen diese noch gebräuchlichen Bezeichnungen nicht mehr.
Eigenschaften
Physikalische Eigenschaften
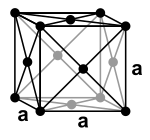
Blei ist ein unedles Metall mit einem Standard elektrodenpotential von etwa −0,13 V. [44] Es ist allerdings edler als viele andere Gebrauchsmetalle, wie Eisen, Zink oder Aluminium. Es ist ein diamagnetisches Schwermetall mit einer Dichte von 11,3 g/cm³, das kubisch-flächenzentriert kristallisiert und damit eine kubisch dichteste Kugelpackung mit der Raumgruppe Fm 3 m (Raumgruppen-Nr. 225) aufweist. Der Gitterparameter beträgt bei reinem Blei 0,4950 nm [45] (entspricht 4,95 Å ) bei 4 Formeleinheiten pro Elementarzelle . [46]
Darauf gründet die ausgeprägte Duktilität des Metalls und die geringe Mohshärte von 1,5. Es lässt sich daher leicht zu Blechen walzen oder zu Drähten formen, die jedoch wegen ihrer geringen Härte nur wenig beständig sind. Eine diamantartige Modifikation, wie sie von den leichteren Homologen der Gruppe 14 bekannt ist, tritt beim Blei nicht auf. Das liegt an der relativistisch bedingten Instabilität der Pb-Pb-Bindung und an der geringen Tendenz, vierwertig aufzutreten.
Frische Bleiproben sind von grauweißer bis metallisch weißer Farbe und zeigen einen typisch metallischen Glanz , der aber durch oberflächliche Oxidation sehr schnell abnimmt. Die Farbe wechselt dabei ins Dunkelgraue und wird matt. Auf Papier hinterlässt das weiche Metall einen (blei)grauen Strich . Aus diesem Grund wurde früher mit Blei geschrieben und gemalt. Der Name „ Bleistift “ blieb bis heute erhalten, obwohl man seit langem dafür Graphit benutzt.
Der Schmelzpunkt des Bleis liegt bei 327 °C, sein Siedepunkt bei 1740–1751 °C (Werte in Fachliteratur unterschiedlich: 1740 °C, [47] 1746 °C, [44] 1751 °C [48] ). Blei leitet als typisches Metall sowohl Wärme als auch Strom , dies aber deutlich schlechter als andere Metalle (vgl. elektrische Leitfähigkeit Blei: 4,8 · 10 6 S/m, [48] Silber: 62 · 10 6 S/m [48] ). Unterhalb von 7,196 K zeigt Blei keinen elektrischen Widerstand , es wird zum Supraleiter vom Typ I. Die Schallgeschwindigkeit in Blei liegt bei etwa 1200 m/s, in der Literatur streuen die Werte etwas, wahrscheinlich bedingt durch unterschiedliche Reinheit oder Bearbeitung.
Chemische Eigenschaften
An der Luft wird Blei durch Bildung einer Schicht aus Bleioxid passiviert und damit vor weiterer Oxidation geschützt. Frische Schnitte glänzen daher zunächst metallisch, laufen jedoch schnell unter Bildung einer matten Oberfläche an. In feinverteiltem Zustand ist Blei leichtentzündlich ( pyrophores Blei ).
Auch in diversen Säuren ist Blei durch Passivierung unlöslich. So ist Blei beständig gegen Schwefelsäure , Flusssäure und Salzsäure , da sich mit den Anionen der jeweiligen Säure unlösliche Bleisalze bilden. Deshalb besitzt Blei für spezielle Anwendungen eine gewisse Bedeutung im chemischen Apparatebau.
Löslich ist Blei dagegen in Salpetersäure ( Blei(II)-nitrat ist wasserlöslich), heißer, konzentrierter Schwefelsäure (Bildung des löslichen Pb(HSO 4 ) 2 -Komplexes), Essigsäure (nur bei Luftzutritt) und heißen Laugen .
In Wasser, das keinen Sauerstoff enthält, ist metallisches Blei stabil. Bei Anwesenheit von Sauerstoff löst es sich jedoch langsam auf, so dass bleierne Trinkwasserleitungen eine Gesundheitsgefahr darstellen können. Wenn das Wasser dagegen viele Hydrogencarbonat- und Sulfationen enthält, was meist mit einer hohen Wasserhärte einhergeht, bildet sich nach einiger Zeit eine Schicht basischen Bleicarbonats und Bleisulfats . Diese schützt das Wasser vor dem Blei, jedoch geht selbst dann noch etwas Blei aus den Leitungen in das Wasser über.
Isotope
Natürlich vorkommendes Blei besteht im Mittel zu etwa 52,4 % aus dem Isotop 208 Pb, zu etwa 24,1 % aus 206 Pb, zu etwa 22,1 % aus 207 Pb, und zu etwa 1,4 % 204 Pb. Die Zusammensetzung ist je nach Lagerstätte geringfügig verschieden, so dass mit einer Analyse der Isotopenzusammensetzung die Bleiherkunft festgestellt werden kann. Das ist für historische Funde aus Blei und Erkenntnisse früherer Handelsbeziehungen von Bedeutung.
Die drei erstgenannten Isotope sind stabil. Bei 204 Pb handelt es sich um ein primordiales Radionuklid . Es zerfällt unter Aussendung von Alphastrahlung mit einer Halbwertszeit von 1,4 · 10 17 Jahren (140 Billiarden Jahre) in 200 Hg . 208 Pb besitzt einen doppelt magischen Kern ; es ist das schwerste stabile Nuklid. (Das noch schwerere, lange für stabil gehaltene 209 Bi ist nach neueren Messungen [49] instabil und zerfällt mit einer Halbwertszeit von (1,9 ± 0,2)· 10 19 Jahren (19 Trillionen Jahre) unter Aussendung von Alphateilchen in 205 Tl . Sein sehr langsamer Zerfall ist darin begründet, dass es mit Z=83 nur ein Proton mehr als die magische Protonenzahl von 82 und die magische Neutronenzahl 126 aufweist, also sehr ähnlich aufgebaut ist wie der doppelt magische Bleikern mit 208 Nukleonen).
Die stabilen Isotope des natürlich vorkommenden Bleis sind jeweils die Endprodukte der Uran- und Thorium-Zerfallsreihen: 206 Pb ist das Endnuklid der beim 238 U beginnenden Uran-Radium-Reihe , 207 Pb ist das Ende der beim 235 U beginnenden Uran-Actinium-Reihe und 208 Pb das Ende der beim 244 Pu bzw. 232 Th beginnenden Thorium-Reihe . Durch diese Zerfallsreihen kommt es zu dem Effekt, dass das Verhältnis der Bleiisotope in einer Probe bei Ausschluss eines stofflichen Austausches mit der Umwelt zeitlich nicht konstant ist. Dies kann zur Altersbestimmung durch die Uran-Blei- bzw. Thorium-Blei-Methode genutzt werden, die auf Grund der langen Halbwertszeiten der Uran- und Thoriumisotope im Gegensatz zur Radiokarbonmethode gerade zur Datierung von Millionen Jahre alten Proben tauglich ist. Außerdem führt der Effekt zu differenzierten Isotopensignaturen im Blei aus verschiedenen Lagerstätten, was zum Herkunftsnachweis herangezogen werden kann.
Weiterhin existieren noch 33 instabile Isotope und 13 instabile Isomere von 178 Pb bis 215 Pb, [50] die entweder künstlich hergestellt wurden oder in den Zerfallsreihen des Urans bzw. des Thoriums vorkommen, wie etwa 210 Pb in der Uran-Radium-Reihe. Das langlebigste Isotop unter ihnen ist 205 Pb mit einer Halbwertszeit von 153 Millionen Jahren.
→ Liste der Blei-Isotope
Verwendung
Die größten Bleiverbraucher sind die USA, Japan, Deutschland und die Volksrepublik China. Der Verbrauch ist stark von der Konjunktur in der Automobilindustrie abhängig, in deren Akkumulatoren etwa 60 % des Weltbedarfs an Blei verwendet werden. Weitere 20 % werden in der chemischen Industrie verarbeitet.
Strahlenabschirmung
Wegen seiner hohen Atommasse eignet sich Blei in ausreichend dicken Schichten oder Blöcken zur Abschirmung gegen Gamma- und Röntgenstrahlung ; es absorbiert Röntgen- und Gammastrahlung sehr wirksam. Blei ist hierfür billiger und leichter zu verarbeiten, etwa als weiches Blech, als noch „atom-schwerere“, dichtere Metalle. Deshalb wird es ganz allgemein im Strahlenschutz (z. B. Nuklearmedizin , Radiologie , Strahlentherapie ) zur Abschirmung benutzt. Ein Beispiel ist die Blei schürze , welche Ärzte und Patienten bei Röntgenaufnahmen tragen. Bleiglas wird ebenfalls zum Strahlenschutz verwendet.
Im Krankenhausbereich ist als technische Angabe bei baulichen Einrichtungen mit Abschirmfunktion wie Wänden, Türen, Fenster der Bleidickegleichwert üblich und oft angeschrieben, um die Wirksamkeit von Strahlenschutz und Strahlenbelastung berechnen zu können.
Blei wird deshalb z. B. auch für Streustrahlenraster eingesetzt.
Einen besonderen Anwendungsfall stellt die Abschirmung von Gamma-Spektrometern für die Präzisionsdosimetrie dar. Hierfür wird Blei mit möglichst geringer Eigen-Radioaktivität benötigt. Der natürliche Gehalt an radioaktivem 210 Pb wirkt sich störend aus. Er fällt umso niedriger aus, je länger der Verhüttungszeitpunkt zurückliegt, denn mit der Verhüttung werden die Mutter-Nuklide aus der Uran-Radium-Reihe (Begleiter im Erz) vom Blei abgetrennt. Das 210 Pb zerfällt daher vom Zeitpunkt der Verhüttung an mit seiner Halbwertszeit von 22,3 Jahren, ohne dass neues nachgebildet wird. Deshalb sind historische Bleigegenstände wie etwa Trimmgewichte aus gesunkenen Schiffen oder historische Kanonenkugeln zur Gewinnung von strahlungsarmem Blei für die Herstellung solcher Abschirmungen begehrt. Auch gibt es noch andere Forschungseinrichtungen, die aus ähnlichen Gründen dieses alte Blei benötigen. [51]
Metall
Blei wird vorwiegend als Metall oder Legierung verwendet. Im Gegensatz zu früheren Zeiten, als Blei eines der wichtigsten und meistverwendeten Metalle war, versucht man heute, Blei durch andere, ungiftige Elemente oder Legierungen zu ersetzen. Wegen seiner wichtigen Eigenschaften, vor allem seiner Korrosionsbeständigkeit und hohen Dichte sowie seiner einfachen Herstellung und Verarbeitung, hat es aber immer noch eine große Bedeutung in der Industrie. Elemente mit einer ähnlichen oder noch höheren Dichte beispielsweise sind entweder noch problematischer ( Quecksilber , Uran ) oder sehr selten und teuer ( Wolfram , Gold , Platin ).
Elektrotechnik
Das meiste Blei wird heutzutage für chemische Energiespeicher in Form von Bleiakkumulatoren (z. B. für Autos) verwendet. Ein Autoakku enthält eine Blei- und eine Blei(IV)-oxid-Elektrode sowie verdünnte Schwefelsäure (37 %) als Elektrolyt. Aus den bei der elektrochemischen Reaktion entstehenden Pb 2+ -Ionen bildet sich in der Schwefelsäure unlösliches Blei(II)-sulfat. Wiederaufladen ist durch die Rückreaktion von Blei(II)-sulfat zu Blei und Blei(IV)-oxid möglich. Ein Vorteil des Bleiakkumulators ist die hohe Nennspannung einer Akkuzelle von 2,06 Volt .
Maschinenbau
Da Blei eine hohe Dichte besitzt, wird es als Gewicht benutzt. Umgangssprachlich gibt es deshalb die Bezeichnung „bleischwer“ für sehr schwere Dinge. Bleigewichte wurden unter anderem als Ausgleichsgewichte zum Auswuchten von Autorädern benutzt. Dies ist aber seit dem 1. Juli 2003 bei PKW-Neuwagen und seit dem 1. Juli 2005 bei allen PKW (bis 3,5 t) verboten; die Bleigewichte sind durch Zink- oder Kupfergewichte ersetzt worden. Weitere Anwendungen unter Ausnutzung der hohen Dichte sind: Bleiketten zur Straffung von Gardinen und Tauchgewichte, um beim Tauchen den Auftrieb von Taucher und Ausrüstung auszugleichen. Außerdem wird Blei als Schwingungsdämpfer in vibrationsempfindlichen (Auto-)Teilen, zur Stabilisierung von Schiffen und für Sonderanwendungen des Schallschutzes verwendet.
Apparatebau
Blei ist durch Passivierung chemisch sehr beständig und widersteht ua Schwefelsäure und Brom . Daher wird es als Korrosionsschutz im Apparate- und Behälterbau eingesetzt. Eine früher wichtige Anwendung war das Bleikammerverfahren zur Schwefelsäureherstellung, da damals Blei das einzige bekannte Metall war, das den Schwefelsäuredämpfen widerstand. Auch frühere Anlagen und Räume zur Herstellung von Nitroglyzerin wurden an Boden und Wand mit Blei ausgekleidet. [52] Blei wurde auch häufig zur Ummantelung von Kabeln zum Schutz vor Umwelteinflüssen benutzt, beispielsweise bei Telefonkabeln. Heute ist Blei dabei meist durch Kunststoffe , z. B. PVC, abgelöst worden, wird aber bis heute bei Kabeln in Raffinerien eingesetzt, da es auch gegen Kohlenwasserstoffe unempfindlich ist.
Bauwesen
Da Blei leicht zu bearbeiten und zu gießen ist, wurde Blei in der Vergangenheit häufig für metallische Gegenstände verwendet. Zu den wichtigsten Bleiprodukten zählten ua Rohre. Aufgrund der Toxizität der aus dem Blei evtl. entstehenden chemischen Verbindungen ( Bleivergiftung ) kommen Bleirohre aber seit den 1970er Jahren nicht mehr zum Einsatz. Trotz einer gebildeten Karbonatschicht in den Rohren löst sich das Blei weiterhin im Trinkwasser . Erfahrungsgemäß wird bereits nach wenigen Metern der Grenzwert der geltenden Trinkwasserverordnung nicht mehr eingehalten.
Weitere Verwendung im Hochbau fand Blei zur Verbindung von Steinen durch eingegossene Metallklammern oder Metalldübel, etwa um Scharniere an einen steinernen Türstock zu befestigen oder ein Eisengeländer an einer Steintreppe. Diese Verbleiungstechnik ist in der Restaurierung noch weit verbreitet. So an der Turmspitze im Wiener Stephansdom oder der Brücke in Mostar . Auch für Fensterfassungen, z. B. an mittelalterlichen Kirchenfenstern, wurden oft Bleiruten verwendet. Blei (Walzblei) findet auch Verwendung als Dachdeckung (z. B. die Hauptkuppeln der Hagia Sophia ) oder für Dachabschlüsse (z. B. bei den berühmten „ Bleikammern “, dem ehemaligen Gefängnis von Venedig und im Kölner Dom) sowie zur Einfassung von Dachöffnungen. Auch wurde früher Farben und Korrosionsschutzanstrichen Blei beigemischt, insbesondere bei Anstrichen für Metalloberflächen. Noch heute stellt Blei bei Gebäuden im Bestand einen zu berücksichtigenden Gebäudeschadstoff dar, da es in vielen älteren Bau- und Anlageteilen weiterhin zu finden ist.
Pneumatiksteuerungen
Ein spezieller Anwendungsbereich von Bleirohren waren ab dem späten 19. Jahrhundert pneumatische Steuerungen für Orgeln ( pneumatische Traktur ), pneumatische Kunstspielklaviere und, als ein spezieller und sehr erfolgreicher Einsatzfall, die Steuerung der Link-Trainer , des ersten weitverbreiteten Flugsimulators. Die Vorteile von Bleirohren (billig, stabil, flexibel, kleiner Platzbedarf für die nötigen umfangreichen Rohrbündel, lötbar, mechanisch leicht zu verarbeiten, langlebig) waren dafür ausschlaggebend.
Militärtechnik
Ein wichtiger Abnehmer für Bleimetall war und ist das Militär. Blei dient als Grundstoff für Geschosse, sowohl für Schleudern als auch für Feuerwaffen. In sogenannten Kartätschen wurde gehacktes Blei verschossen. Der Grund für die Verwendung von Blei waren und sind einerseits die hohe Dichte und damit hohe Durchschlagskraft und andererseits die leichte Herstellung durch Gießen. Heutzutage wird das Blei meist von einem Mantel (daher „ Mantelgeschoss “) aus einer Kupferlegierung ( Tombak ) umschlossen. Vorteile sind vor allem eine höhere erreichbare Geschossgeschwindigkeit, bei der ein nicht ummanteltes Bleigeschoss aufgrund seiner Weichheit nicht mehr verwendet werden kann, und die Verhinderung von Bleiablagerungen im Inneren des Laufes einer Feuerwaffe. Bleifreie Munition ist jedoch auch verfügbar.
Karosseriereparatur
Vor dem Aufkommen moderner 2-Komponenten- Spachtelmasse wurden Blei oder Blei-Zinn-Legierungen aufgrund ihres geringen Schmelzpunktes zum Ausfüllen von Schad- und Reparaturstellen an Fahrzeugkarosserien genutzt. Dazu wurde das Material mit Lötbrenner und Flussmittel auf die Schadstelle aufgelötet . Anschließend wurde die Stelle wie beim Spachteln verschliffen. Dies hat den Vorteil, dass das Blei im Gegensatz zu Spachtelmasse eine feste Bindung mit dem Blech eingeht und bei Temperaturschwankungen auch dessen Längenausdehnung mitmacht. Da die entstehenden Dämpfe und Stäube giftig sind, wird dieses Verfahren heute außer bei der Restaurierung historischer Fahrzeuge kaum noch verwendet.
Brauchtum
Ein alter Orakel -Brauch, den bereits die Römer pflegten, ist das Bleigießen , bei dem flüssiges Blei (heutzutage auch in Legierung mit Zinn) in kaltem Wasser zum Erstarren gebracht wird. Anhand der zufällig entstehenden Formen sollen Weissagungen über die Zukunft getroffen werden. Heute wird der Brauch noch gerne zu Neujahr geübt, um einen (nicht unbedingt ernst genommenen) Ausblick auf das kommende Jahr zu bekommen.
Wassersport
Beim Tauchen werden Bleigewichte zum Tarieren verwendet; der hohe Dichteüberschuss (gut 10 g/cm³) gegenüber Wasser liefert kompakt den Abtrieb, so dass ein Taucher auch in geringer Wassertiefe schweben kann. Für die Verwendung von Blei als Gewicht ist ferner der vergleichsweise niedrige Preis begünstigend: Ausgehend von den Weltmarktpreisen für Metalle vom Juli 2013 hat Blei ein hervorragendes Preis-Gewichts-Verhältnis. Die Verwendung erfolgt in Form von Platten an den Schuhsohlen eines Panzertauchanzugs, als abgerundete Blöcke aufgefädelt auf einem breiten Hüftgurt oder – modern – als Schrotkugeln in Netzen in den Taschen einer Tarierweste. Öffnen der Gurtschnalle oder der Taschen (unten) erlaubt es, den Ballast notfalls rasch abzuwerfen.
Der Kielballast von Segelyachten besteht bevorzugt aus Blei. Eisenschrott ist zwar billiger, aber auch weniger dicht, was bei den heute üblichen schlanken Kielen nicht optimal ist. Neben der Dichte ist ein weiter Vorteil, dass Blei nicht rostet und daher auch bei einem Schaden in der Kielverkleidung nicht degeneriert.
Legierungsbestandteil
Blei wird auch in einigen wichtigen Legierungen eingesetzt. Durch das Zulegieren weiterer Metalle ändern sich je nach Metall die Härte , der Schmelzpunkt oder die Korrosionsbeständigkeit des Materials. Die wichtigste Bleilegierung ist das Hartblei , eine Blei-Antimon-Legierung, die erheblich härter und damit mechanisch belastbarer als reines Blei ist. Spuren einiger anderer Elemente (Kupfer, Arsen, Zinn) sind meist in Hartblei enthalten und beeinflussen ebenfalls maßgeblich die Härte und Festigkeit. Verwendung findet Hartblei beispielsweise im Apparatebau, bei dem es neben der chemischen Beständigkeit auch auf Stabilität ankommt.
Eine weitere Bleilegierung ist das Letternmetall , eine Bleilegierung mit 60–90 % Blei, die als weitere Bestandteile Antimon und Zinn enthält. Es wird für Lettern im klassischen Buchdruck verwendet, spielt heute allerdings in der Massenproduktion von Druckgütern keine Rolle mehr, sondern allenfalls für bibliophile Editionen. Daneben wird Blei in Lagern als so genanntes Lagermetall verwendet.
Blei spielt eine Rolle als Legierungsbestandteil in Weichlot , das unter anderem in der Elektrotechnik Verwendung findet. In Weichloten ist Zinn neben Blei der wichtigste Bestandteil. Die Verwendung von Blei in Loten betrug 1998 weltweit etwa 20.000 Tonnen. Die EG-Richtlinie 2002/95/EG RoHS verbannt Blei seit Juli 2006 weitgehend aus der Löttechnik . Für spezielle Anwendungen gibt es jedoch eine Reihe von Ausnahmen. [53]
Blei ist ein häufiger Nebenbestandteil in Messing . Dort hilft ein Bleianteil (bis 3 %), die Zerspanbarkeit zu verbessern. Auch in anderen Legierungen, wie z. B. Rotguss , kann Blei als Nebenbestandteil enthalten sein. Daher ist es ratsam, nach längerem Stehen das erste aus Messingarmaturen kommende Wasser wegen etwas herausgelösten Bleis eher nicht zu trinken. [54]
Bleifrei
Bleihaltige Produkte und Anwendungen werden entweder vollständig ersetzt (wie Tetraethylblei im Benzin ) oder der Bleigehalt durch Grenzwerte auf einen der technischen Verunreinigung entsprechenden Wert beschränkt (z. B. Zinn und Lot ). Diese Produkte werden gern „bleifrei“ genannt. Grenzwerte gibt es ua in der Gesetzgebung um die so genannte RoHS (Richtlinie 2011/65/EU), die 1000 ppm (0,1 %) vorsieht. Strenger ist der Grenzwert für Verpackungen mit 100 ppm (Richtlinie 94/62/EG).
Der politische Wille zum Ersetzen des Bleis gilt auch dort, wo die Verwendung aufgrund der Eigenschaften technisch oder wirtschaftlich interessant wäre, die Gesundheitsgefahr gering und ein Recycling mit sinnvollem Aufwand möglich wäre (z. B. Blei als Dacheindeckung).
Bleiglas
Wegen der abschirmenden Wirkung des Bleis besteht der Konus von Kathodenstrahlröhren (dh der „hintere“ Teil der Röhre) für Fernseher , Computer bildschirme etc. aus Bleiglas . Das Blei absorbiert die in Kathodenstrahlröhren zwangsläufig entstehenden weichen Röntgenstrahlen . Für diesen Verwendungszweck ist Blei noch nicht sicher zu ersetzen, daher wird die RoHS-Richtlinie hier nicht angewendet. Glas mit sehr hohem Bleigehalt wird wegen dieser Abschirmwirkung auch in der Radiologie sowie im Strahlenschutz (zum Beispiel in Fensterscheiben) verwendet. Ferner wird Bleiglas wegen seines hohen Brechungsindexes für hochwertige Glaswaren als sogenanntes Bleikristall verwendet.
Toxizität
Elementares Blei kann vor allem in Form von Staub über die Lunge aufgenommen werden. Dagegen wird Blei kaum über die Haut aufgenommen. Daher ist elementares Blei in kompakter Form für den Menschen nicht giftig. Metallisches Blei bildet an der Luft eine dichte, schwer wasserlösliche Schutzschicht aus Bleicarbonat. Toxisch sind gelöste Bleiverbindungen sowie Bleistäube, die durch Verschlucken oder Einatmen in den Körper gelangen können. Besonders toxisch sind Organobleiverbindungen, z. B. Tetraethylblei , die stark lipophil sind und rasch über die Haut aufgenommen werden.
Seit 2006 werden einatembare Fraktionen von Blei und anorganische Bleiverbindungen von der MAK-Kommission der Deutschen Forschungsgemeinschaft als krebserzeugend eingestuft: [55]
- Bleiarsenat und Bleichromat in der Kategorie 1 („Stoffe, die beim Menschen Krebs erzeugen und bei denen davon auszugehen ist, dass sie einen Beitrag zum Krebsrisiko leisten. Epidemiologische Untersuchungen geben hinreichende Anhaltspunkte für einen Zusammenhang zwischen einer Exposition beim Menschen und dem Auftreten von Krebs.“),
- Blei und andere anorganische Bleiverbindungen außer Bleiarsenat und Bleichromat in der Kategorie 2 („Stoffe, die als krebserzeugend für den Menschen anzusehen sind, weil durch hinreichende Ergebnisse aus Langzeit-Tierversuchen oder Hinweise aus Tierversuchen und epidemiologischen Untersuchungen davon auszugehen ist, dass sie einen Beitrag zum Krebsrisiko leisten.“).
Blei reichert sich selbst bei Aufnahme kleinster Mengen, die über einen längeren Zeitraum stetig eingenommen werden, im Körper an, da es z. B. in Knochen eingelagert und nur sehr langsam wieder ausgeschieden wird. Blei kann so eine chronische Vergiftung hervorrufen, die sich unter anderem in Kopfschmerzen, Müdigkeit, Abmagerung und Defekten der Blutbildung, des Nervensystems und der Muskulatur zeigt. Bleivergiftungen sind besonders für Kinder und Schwangere gefährlich. Es kann auch Fruchtschäden und Zeugungsunfähigkeit bewirken. Im Extremfall kann die Bleivergiftung zum Tod führen. Die Giftigkeit von Blei beruht unter anderem auf einer Störung der Hämoglobinsynthese . Es hemmt mehrere Enzyme und behindert dadurch den Einbau des Eisens in das Hämoglobinmolekül. Dadurch wird die Sauerstoff-Versorgung der Körperzellen gestört.
Bleiglas und Bleiglasur eignet sich nicht für Ess- und Trinkgefässe, da Essig(säure) Blei als wasserlösliches Bleiazetat aus dem Silikatverbund herauslösen kann. Als Automotoren noch mit Benzin mit Bleitetraethyl liefen, war die Vegetation in der Nähe von Straßen und in den Städten mit Blei, als Oxidstaub, belastet. Raue und vertiefte Oberflächen, etwa die Einziehung rund um den Stängel eines Apfels, sind Fallen für Staub.
Bleibelastung der Umwelt
Luft
Die Bleibelastung der Luft wird hauptsächlich durch bleihaltige Stäube verursacht: Hauptquellen sind die Blei-erzeugende Industrie, die Verbrennung von Kohle und bis vor einigen Jahren vor allem der Autoverkehr durch die Verbrennung bleihaltiger Kraftstoffe in Automotoren – durch Reaktion mit dem Benzin zugesetzten halogenierten Kohlenwasserstoffen entstand aus dem zugesetzten Bleitetraethyl neben geringeren Mengen an Blei(II)-chlorid und Blei(II)-bromid vor allem Blei und Blei(II)-oxid . Infolge des Verbotes bleihaltiger Kraftstoffe ist die entsprechende Luftbelastung in den letzten Jahren deutlich zurückgegangen.
Am höchsten ist die Bleibelastung durch Bleistäube derzeit bei der Arbeit in Blei-produzierenden und -verarbeitenden Betrieben. Auch beim Reinigen und Entfernen alter Mennige -Anstriche durch Sandstrahlen entsteht Bleistaub. Die bei der Bleiraffination und der Verbrennung von Kohle entstehenden Bleioxidstäube konnten durch geeignete Filter verringert werden. Eine weitere Quelle, die mengenmäßig aber kaum ins Gewicht fällt, ist die Verbrennung von Hausmüll in Müllverbrennungsanlagen .
Sport- und andere Schützen sind erheblichen Belastungen durch im Mündungs - bzw. Zündfeuer enthaltene (Schwer)metalle ausgesetzt, darunter neben Antimon , Kupfer und Quecksilber eben auch Blei; [56] Vorsorge kann durch den Betrieb entsprechender Absauganlagen auf Schießständen sowie durch den Gebrauch bleifreier Munition getroffen werden. [57]
Boden
Auch Böden können mit Blei belastet sein. Der mittlere Bleigehalt der kontinentalen Erdkruste liegt bei 15 mg/kg. Böden enthalten von Natur aus zwischen 2 und 60 mg/kg Blei; wenn sie aus bleierzhaltigen Gesteinen entstanden sind, kann der Gehalt deutlich höher sein. [58] Der Großteil der Bleibelastung von Böden ist anthropogen , die Quellen dafür sind vielfältig. Der Großteil des Eintrags erfolgt über Bleistäube aus der Luft, welche mit dem Regen oder durch trockene Deposition in die Böden gelangen. Für Deutschland und das Jahr 2000 wurde der atmosphärische Eintrag in Böden auf 571 t Blei/Jahr geschätzt. Eine weitere Quelle ist belasteter Dünger , sowohl Mineraldünger (136 t Pb/a), insbesondere Ammonsalpeter , als auch Wirtschaftsdünger (182 t Pb/a). Klärschlämme (90 t Pb/a) und Kompost (77 t Pb/a) tragen ebenfalls zur Bleibelastung der Böden bei. [59] Ein erheblicher Eintrag erfolgt auch durch Bleischrot-Munition. [60] [61] Bei Altlasten, wie z. B. an ehemaligen Standorten von bleiproduzierenden Industriebetrieben oder in der Umgebung von alten bleiummantelten Kabeln, kann der Boden ebenfalls eine hohe Bleibelastung aufweisen. Eine besonders große Bleiverseuchung hat beispielsweise im Ort Santo Amaro da Purificação ( Brasilien ) zu hohen Belastungen bei Kindern geführt [62] .
Wasser
Die Bleibelastung der Gewässer resultiert hauptsächlich aus dem Ausschwemmen von Blei aus belasteten Böden. Dazu tragen auch geringe Mengen bei, die der Regen aus Bleiwerkstoffen wie Dachplatten löst. Die direkte Verschmutzung von Gewässern durch die Bleiindustrie und den Bleibergbau spielt (zumindest in Deutschland) auf Grund des Baus von Kläranlagen fast keine Rolle mehr. Der Jahreseintrag von Blei in Gewässer ist in Deutschland von ca. 900 t im Jahr 1985 auf ungefähr 300 t im Jahr 2000 zurückgegangen. [63]
In Deutschland beträgt der Grenzwert im Trinkwasser seit dem 1. Dezember 2013 10 µg/l (früher 25 µg/l) [26] ; die Grundlage der Messung ist eine für die durchschnittliche wöchentliche Wasseraufnahme durch Verbraucher repräsentative Probe (siehe Trinkwasserverordnung ).
Nahrung
Durch die Bleibelastung von Luft, Boden und Wasser gelangt das Metall über Pilze, Pflanzen und Tiere in die Nahrungskette des Menschen. Besonders hohe Bleibelastungen können in verschiedenen Pilzen enthalten sein. Auf den Blättern von Pflanzen lagert sich Blei als Staub ab, das war charakteristisch für die Umgebung von Straßen mit viel Kfz-Verkehr, als Benzin noch verbleit wurde. Dieser Staub kann durch sorgfältiges Waschen entfernt werden. Zusätzliche Quellen können bleihaltige Munition bei gejagten Tieren sein. Blei kann auch aus bleihaltigen Glasuren von Keramikgefäßen in Lebensmittel übergehen. In frischem Obst und Gemüse ist in den allermeisten Fällen Blei und Cadmium nicht oder nur in sehr geringen Spuren nachweisbar. [64]
Wasserleitungen aus Bleirohren können das Trinkwasser belasten. Sie sind in Deutschland erst seit den 1970er Jahren nicht mehr verbaut worden. Besonders in Altbauten in einigen Regionen Nord- und Ostdeutschlands sind Bleirohre immer noch anzutreffen. Bei über 5 % der Proben des Wassers aus diesen Gebäuden lagen die Bleiwerte des Leitungswassers laut Stiftung Warentest über dem aktuellen gesetzlichen Grenzwert. [65] Gleiches gilt für Österreich und betrifft Hauszuleitungen der Wasserversorgers und Leitungen im Haus, die Sache des Hauseigentümers sind. Aus bleihaltigem Essgeschirr kann Blei durch saure Lebensmittel (Obst, Wein, Gemüse) herausgelöst werden.
Wasserleitungsarmaturen (Absperrhähne, Formstücke, Eckventil, Mischer) sind meist aus Messing oder Rotguss . Messing wird für gute Zerspanbarkeit 3 % Blei zugesetzt, Rotguss enthält 4–7 %. Ob Blei- und andere Schwermetallionen (Cu, Zn, Ni) in relevantem Ausmaß ins Wasser übertreten, hängt von der Wasserqualität ab: Wasserhärte , pH-Wert , Sauerstoff, Salzgehalt. Mit 2013 wurde der Grenzwert für den Bleigehalt im Trinkwasser herabgesetzt auf 0,01 mg/L. [66] [67] Grundsätzlich kann nach längerem Stehen des Wassers in der Leitung, etwa über Nacht, durch Laufenlassen der Wasserleitung von etwa einer Minute (Spülen) vor der Entnahme für Trinkwasserzwecke der Gehalt aller aus der Leitungswandung eingewanderten Ionen reduziert werden.
Analytik
Klassische qualitative Bestimmung von Blei
Nachweis durch Kristallisation
Bleiionen können in einer mikroskopischen Nachweisreaktion als Blei(II)-iodid dargestellt werden. Dabei wird die Probe in verdünnter Salzsäure gelöst und vorsichtig bis zur Kristallisation eingedampft. Der Rückstand wird mit einem Tropfen Wasser aufgenommen und anschließend mit einem Kristall eines wasserlöslichen Iodids, z. B. Kaliumiodid (KI), versetzt. Es entstehen nach kurzer Zeit mikroskopisch kleine, gelbe, hexagonale Blättchen des Blei(II)-iodids.
Qualitativer Nachweis im Trennungsgang
Da Blei nach Zugabe von HCl nicht quantitativ als PbCl 2 ausfällt, kann es sowohl in der HCl-Gruppe als auch in der H 2 S-Gruppe nachgewiesen werden. Das PbCl 2 kann sowohl durch Zugabe von Kaliumiodid gemäß obiger Reaktion als gelbes PbI 2 gefällt werden, als auch mit K 2 Cr 2 O 7 als gelbes Bleichromat, PbCrO 4 .
Nach Einleiten von H 2 S in die salzsaure Probe fällt zweiwertiges Blei in Form von schwarzem PbS aus. Dieses wird nach Digerieren mit (NH 4 )S X und Zugabe von 4 M HNO 3 als PbI 2 oder PbCrO 4 nachgewiesen. [68]
Instrumentelle quantitative Analytik des Bleis
Für die Spurenanalytik von Blei und seinen Organoderivaten steht eine Reihe von Methoden zur Verfügung. Allerdings werden in der Literatur laufend neue bzw. verbesserte Verfahren vorgestellt, auch im Hinblick auf die oft erforderliche Vorkonzentrierung. Ein nicht zu unterschätzendes Problem besteht in der Probenaufarbeitung.
Atomabsorptionsspektrometrie (AAS)
Unter den verschiedenen Techniken der AAS liefert die Quarzrohr- und die Graphitrohrtechnik die besten Ergebnisse für die Spurenanalytik von Bleiverbindungen. Häufig wird Blei mit Hilfe von NaBH 4 in das leicht flüchtige Bleihydrid, PbH 2 , überführt. Dieses wird in eine Quarzküvette geleitet und anschließend elektrisch auf über 900 °C erhitzt. Dabei wird die Probe atomisiert und es wird unter Verwendung einer Hohlkathodenlampe die Absorbanz bei 283,3 nm gemessen. Es wurde eine Nachweisgrenze von 4,5 ng/ml erzielt. Gerne wird in der AAS auch eine Luft-Acetylenfackel (F-AAS) oder mikrowelleninduziertes Plasma (MIP-AAS) zur Atomisierung eingesetzt. [69]
Atomemissionsspektrometrie (AES)
In der AES haben sich das mikrowelleninduzierte Plasma (MIP-AES) und das induktiv gekoppelte Argon-Plasma (ICP-AES) zur Atomisierung bewährt. Die Detektion findet bei den charakteristischen Wellenlängen 283,32 nm und 405,78 nm statt. Mit Hilfe der MIP-AES wurde für Trimethylblei, (CH 3 ) 3 Pb + , eine Nachweisgrenze von 0,19 pg/g ermittelt. [70] Die ICP-AES ermöglicht eine Nachweisgrenze für Blei in Trinkwasser von 15,3 ng/ml. [71] [72]
Massenspektrometrie (MS)
In der Natur treten für Blei insgesamt vier stabile Isotope mit unterschiedlicher Häufigkeit auf. Für die Massenspektrometrie wird häufig das Isotop 206 Pb genutzt. Mit Hilfe der ICP-Quadrupol-MS konnte dieses Isotop im Urin mit einer Nachweisgrenze von 4,2 pg/g bestimmt werden. [73]
Photometrie
Die am weitesten verbreitete Methode zur photometrischen Erfassung von Blei ist die sog. Dithizon-Methode. Dithizon ist ein zweizähniger, aromatischer Ligand und bildet bei pH 9–11,5 mit Pb 2+ -Ionen einen roten Komplex dessen Absorbanz bei 520 nm (ε = 6,9·10 4 l/mol·cm) gemessen wird. Bismut und Thallium stören die Bestimmung und sollten vorher quantitativ gefällt oder extrahiert werden. [74] [75] [76]
Voltammetrie
Für die elektrochemische Bestimmung von Spuren von Blei eignet sich hervorragend die subtraktive anodische Stripping-Voltammetrie (SASV). Dabei geht der eigentlichen voltammetrischen Bestimmung eine reduktive Anreicherungsperiode auf einer rotierenden Ag-Disk-Elektrode voraus. Es folgt die eigentliche Bestimmung durch Messung des Oxidationsstroms beim Scannen eines Potentialfensters von −800 mV bis −300 mV. Anschließend wird die Messung ohne vorangehende Anreicherung wiederholt und die so erhaltene Kurve von der ersten Messung subtrahiert. Die Höhe des verbleibenden Oxidationspeaks bei −480 mV korreliert mit der Menge an vorhandenem Blei. Es wurde eine Nachweisgrenze von 50 pM Blei in Wasser ermittelt. [77] [78]
Bleiverbindungen
→ Kategorie:Bleiverbindung
Bleiverbindungen kommen in den Oxidationsstufen +II und +IV vor. Aufgrund des relativistischen Effekts ist die Oxidationsstufe +II dabei – im Gegensatz zu den leichteren Homologen der Gruppe 14, wie Kohlenstoff und Silicium – stabiler als die Oxidationsstufe +IV. Der Sachverhalt der Bevorzugung der um 2 erniedrigten Oxidationsstufe, findet sich in analoger Weise auch in anderen Hauptgruppen und wird Effekt des inerten Elektronenpaares genannt. Blei(IV)-Verbindungen sind deshalb starke Oxidationsmittel. In intermetallischen Verbindungen des Bleis ( Plumbide : M x Pb y ), vor allem mit Alkali- und Erdalkalimetallen , nimmt es auch negative Oxidationsstufen bis −IV an. Viele Bleiverbindungen sind Salze , es gibt aber auch organische Bleiverbindungen, die kovalent aufgebaut sind. Ebenso wie bei Bleimetall wird heutzutage versucht, Bleiverbindungen durch andere, ungiftige Verbindungen zu substituieren. So wurde „Bleiweiß“ (basisches Blei(II)-carbonat) als Weißpigment durch Titandioxid ersetzt.
Oxide
- Blei(II)-oxid PbO tritt in zwei Modifikationen, als rote Bleiglätte und als gelbes Massicolit, auf. Beide Modifikationen wurden früher als Pigmente verwendet. Es dient als Ausgangsstoff für andere Bleiverbindungen.
- Blei(II,IV)-oxid Pb 3 O 4 , auch Mennige genannt, ist ein leuchtend rotes Pulver, das früher verbreitet als Pigment und Rostschutzfarbe verwendet wurde. Es ist in Deutschland, seit 2005 auch in der Schweiz, als Rostschutz verboten. Pb 3 O 4 wird in der Glasherstellung für die Bereitung von Bleikristall verwendet.
- Blei(IV)-oxid PbO 2 ist ein schwarz-braunes Pulver, das als Elektrodenmaterial in Bleiakkumulatoren und als Oxidationsmittel in der chemischen Industrie (z. B. Farbstoffherstellung) verwendet wird.
Schwefelverbindungen
- Blei(II)-sulfid PbS ist als Galenit ( Bleiglanz ) das wichtigste Bleimineral. Es dient va zur Herstellung metallischen Bleis.
- Blei(II)-sulfat PbSO 4 kommt als Anglesit ebenfalls in der Natur vor und wurde als Weißpigment verwendet.
Weitere Bleisalze
- Blei(II)-acetat Pb(CH 3 COO) 2 · 3H 2 O, auch Bleizucker genannt, war früher ein Zuckerersatzstoff z. B. für das Süßen von Wein. Aufgrund der Giftigkeit von Bleizucker starben früher Menschen an solcherart vergiftetem Wein.
- Blei(IV)-acetat (Pb(CH 3 COO) 4 ) bildet farblose, an feuchter Luft nach Essig riechende Kristallnadeln. Mit Wasser zersetzt es sich zu Blei(IV)-oxid und Essigsäure. Es dient in der Organischen Chemie als starkes Oxidationsmittel.
- Bleiweiß , basisches Bleicarbonat 2 PbCO 3 · Pb(OH) 2 , war früher ein beliebtes Weißpigment; es ist heute meist durch Titanoxid abgelöst.
- Blei(II)-nitrat Pb(NO 3 ) 2 ist ein giftiges, weißes Pulver, das für Sprengstoffe und zur Herstellung von Streichhölzern verwendet wurde.
- Blei(II)-chlorid PbCl 2 dient als Ausgangsstoff zur Herstellung von Bleichromat.
- Blei(II)-chromat PbCrO 4 ist ein orange-gelbes Pulver, welches früher als Pigment diente und heute wegen seiner Giftigkeit nicht mehr eingesetzt wird.
- Bleiazid Pb(N 3 ) 2 ist ein wichtiger Initialsprengstoff .
Organische Bleiverbindungen
Organische Bleiverbindungen liegen fast immer in der Oxidationsstufe +4 vor. Deren bekannteste ist Tetraethylblei Pb(C 2 H 5 ) 4 (TEL), eine giftige Flüssigkeit, die als Antiklopfmittel Benzin zugesetzt wurde. Heute wird Tetraethylblei nur noch in Flugbenzin verwendet.
Literatur
- Gerhart Jander, Ewald Blasius: Einführung in das anorganisch-Chemische Praktikum. 14. Auflage. S. Hirzel, Leipzig 1995, ISBN 3-7776-0672-3 .
- William H. Brock: Viewegs Geschichte der Chemie. Vieweg, Braunschweig 1997, ISBN 3-540-67033-5 .
- Stefan Meier: Blei in der Antike. Bergbau, Verhüttung, Fernhandel. Dissertation . Zürich, Universität 1995.
- Raymund Gottschalk, Albrecht Baumann: Material provenance of late-Roman lead coffins in the Rheinland, Germany. In: European Journal of Mineralogy . 13, Stuttgart 2001, S. 197–200.
- Heiko Steuer , Ulrich Zimmermann: Alter Bergbau in Deutschland . (= Archäologie in Deutschland. Sonderheft). Konrad Theiss, Stuttgart 1993, ISBN 3-8062-1066-7 .
Weblinks
- Mineralienatlas:Blei (Wiki)
- MATERIAL ARCHIV: Blei – Umfangreiche Materialinformationen und Bilder
- Lead Poisoning: A Historical Perspective – Historische Perspektive zur Bleivergiftung (englisch)
- Untersuchung von Batterieverwertungsverfahren und -anlagen hinsichtlich ökologischer und ökonomischer Relevanz unter besonderer Berücksichtigung des Cadmiumproblems ( Memento vom 13. April 2012 im Internet Archive ) (2001, PDF, S. 215–226; 1,37 MB)
- TRGS 505-Technische Regeln für Gefahrstoffe-Blei (PDF; 186 kB)
- Einträge von Blei in die Umwelt (PDF; 3,9 MB)
- Umweltbundesamt: Stoffmonografie Blei (1996) ( Memento vom 27. September 2007 im Internet Archive ) (PDF; 48 kB)
- Molekulare Ursache für Bleivergiftungen
- Lead and Human Health , Environmental Health & Toxicology, Specialized Information Services, National Library of Medicine (en.)
- Blei – Informationen des Bundesamts für Lebensmittelsicherheit und Veterinärwesen
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3 .
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus www.webelements.com (Blei) entnommen.
- ↑ CIAAW, Standard Atomic Weights Revised 2013 .
- ↑ a b c d e Eintrag zu lead in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1) . Hrsg.: NIST , Gaithersburg, MD. doi : 10.18434/T4W30F ( https://physics.nist.gov/asd ). Abgerufen am 13. Juni 2020.
- ↑ a b c d e Eintrag zu lead bei WebElements, https://www.webelements.com , abgerufen am 13. Juni 2020.
- ↑ NN Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9 , S. 482.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics . 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Properties of the Elements and Inorganic Compounds, S. 4-142 – 4-147. Die Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ a b Yiming Zhang, Julian RG Evans, Shoufeng Yang: Corrected Values for Boiling Points and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data . 56, 2011, S. 328–337, doi:10.1021/je1011086 .
- ↑ a b CA Sutherland, EF Milner, RC Kerby, H. Teindl, A. Melin, HM Bolt: Lead. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2006, doi : 10.1002/14356007.a15_193.pub2
- ↑ a b c d Eintrag zu Blei, Pulver in der GESTIS-Stoffdatenbank des IFA , abgerufen am 30. April 2017. (JavaScript erforderlich)
- ↑ Eintrag zu Lead im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern .
- ↑ Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur , abgerufen am 21. April 2020.
- ↑ Gmelin-Institut für anorganische Chemie und Grenzg: Blei Teil A 1: Geschichtliches . Springer-Verlag, 2013, ISBN 978-3-662-11844-3 , S. 6 ( eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Betina Faist : Der Fernhandel des assyrischen Reiches zwischen dem 14. und dem 11. Jahrhundert vor Christus (= Alter Orient und Altes Testament. Band 265). Ugarit Verlag, Münster 2001, S. 45.
- ↑ a b Hans Schwerteck: Blei. In: Der Neue Pauly (DNP). Band 2, Metzler, Stuttgart 1997, ISBN 3-476-01472-X , Sp. 707–709, hier Sp. 707.
- ↑ Peter Kritzinger : Ein neues Zeugnis eines alten Bekannten: Bleisiegel, Bleihandel und Bleiproduktion im freien Germanien. In: Marburger Beiträge zur Antiken Handels-, Wirtschafts- und Sozialgeschichte . Band 35, 2017, S. 87–107, hier S. 102 (insbesondere Anm. 55) ( online ).
- ↑ a b c Hans Schwerteck: Blei. In: Der Neue Pauly (DNP). Band 2, Metzler, Stuttgart 1997, ISBN 3-476-01472-X , Sp. 707–709, hier Sp. 708.
- ↑ Dietwulf Baatz : Schleudergeschosse aus Blei. Eine waffentechnische Untersuchung. In: Saalburg-Jahrbuch. Band 45, 1990, S. 59–67.
- ↑ Vitruv, De architectura 8,6,10–11 (Text: lat. dt. ).
- ↑ BENZINBLEIGESETZ: BENZINBLEIGESETZ , abgerufen am 24. März 2018
- ↑ Bill Bryson: Eine kurze Geschichte von fast allem . Goldmann Verlag, 2011, ISBN 978-3-641-07924-6 , S. 219 ( eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Wolfgang Piersig: Blei – Metall der Antike, der Gegenwart, Mit Zukunft, ein Werkstoff Für Technik, Kultur, Kunst . GRIN Verlag, 2011, ISBN 978-3-656-07290-4 , S. 8 ( eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Bundesanstalt für Arbeitsschutz und Arbeitsmedizin: BAuA – Dokumentationen – Dokumentation des Stakeholder-Workshops „Sanierung von Holzfenstern mit bleihaltigen Anstrichen“ am 16. Februar 2009 – Bundesanstalt für Arbeitsschutz und Arbeitsmedizin , abgerufen am 24. März 2018
- ↑ Technische Universität Dresden Fakultät Umweltwissenschaften: Untersuchungen zur Verbreitung bleifreier Jagdmunition – Eine diffusionstheoretische Betrachtung zur Akzeptanz einer potenziellen Umweltinnovation , Dissertation von Jan Engel
- ↑ Drucksache 700/17 (Beschluss) 15.12.17 zur Verordnung zur Neuordnung trinkwasserrechtlicher Vorschriften , Entschließung B 4.
- ↑ a b Niedersächsisches Landesgesundheitsamt : Fragen und Antworten zu Blei im Trinkwasser , abgerufen am 21. Januar 2020
- ↑ Art. 67 Abs. 1 der Verordnung (EG) Nr. 1907/2006 i. V. m. mit Anhang XVII Nr. 30 zu dieser sogenannten REACH-Verordnung und mit Anhang VI Teil 3 zur Verordnung (EG) Nr. 1272/2008 (die sogenannte CLP-Verordnung ). Das Verbot erfolgte durch Aufnahme von Blei als Pulver (Partikelgröße unter 1 mm, Index-Nr. 082-13-00-1) oder massiv (Index-Nr. 082-14-00-7) in die Liste der fortpflanzungsgefährdenden Stoffe (hier der Kategorie 1A) gemäß Tabelle 3 zum zuvor genannten Anhang zur CLP-Verordnung und gemäß Anlage 5 zum zuvor genannten Anhang zur REACH-Verordnung durch die Verordnung (EU) 2017/1510 der Kommission vom 30. August 2017 mit Wirkung ab 1. März 2018. Ein Verstoß gegen dieses Verbot des Inverkehrbringens z. B. durch Verkauf von solchem Blei an „privat“ zum Bleigießen u. ä. ist daher in Deutschland nach § 5 Nr. 20 Chemikalien-Sanktionsverordnung i. V. m. § 27 Chemikaliengesetz eine Straftat (Stand Juli 2019).
- ↑ Hans Breuer: Allgemeine und anorganische Chemie. (= dtv-Atlas Chemie. Band 1). 9. Auflage. dtv, München 2000, ISBN 3-423-03217-0 , S. 151.
- ↑ a b Fundortliste für gediegen Blei beim Mineralienatlas und bei Mindat
- ↑ a b Lead . In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.): Handbook of Mineralogy, Mineralogical Society of America . 2001 ( handbookofmineralogy.org [PDF; 57 kB ; abgerufen am 12. Januar 2018]).
- ↑ Webmineral – Mineral Species sorted by the element Pb (Lead) (englisch).
- ↑ Fraunhofer-Institut: Trends der Angebots- und Nachfragesituation bei mineralischen Rohstoffen. ( Memento vom 10. März 2013 im Internet Archive ) (PDF, 350 S.; 2,1 MB).
- ↑ a b Friedrich Klockmann : Klockmanns Lehrbuch der Mineralogie . Hrsg.: Paul Ramdohr , Hugo Strunz . 16. Auflage. Enke, Stuttgart 1978, ISBN 3-432-82986-8 , S. 396 (Erstausgabe: 1891).
- ↑ Richard V. Gaines, H. Catherine W. Skinner, Eugene E. Foord, Brian Mason , Abraham Rosenzweig: Dana's New Mineralogy . 8. Auflage. John Wiley & Sons, New York (ua) 1997, ISBN 0-471-19310-0 , S. 5 .
- ↑ IMA/CNMNC List of Mineral Names; July 2019 (PDF 1,67 MB; Blei (Lead) siehe S. 106)
- ↑ IMA/CNMNC List of Mineral Names; 2009 (PDF 1,8 MB, Blei (Lead) siehe S. 161).
- ↑ Webmineral – Minerals Arranged by the New Dana Classification. 01.01.01 Gold group
- ↑ Bildbeispiele von plattigem und dendritischem Blei bei mindat.org
- ↑ Bildbeispiel einer mikroskopischen Aufnahme von oktaedrischen Bleikristallen bei mindat.org
- ↑ United States Geological Survey.
- ↑ Statistik: Weltweiter Bleiverbrauch bis 2016 | Statistik , abgerufen am 24. März 2018
- ↑ Statistik: • Weltweite Bleiproduktion bis 2016 | Statistik , abgerufen am 24. März 2018
- ↑ QSL bei berzelius.de ( Memento vom 29. September 2007 im Internet Archive )
- ↑ a b Michael Binnewies: Allgemeine und anorganische Chemie. Spektrum, Heidelberg 2004, ISBN 3-8274-0208-5 .
- ↑ Ralph WG Wyckoff: Crystal Structures . 2. Auflage. Band 1 . John Wiley & Sons, New York, London, Sydney 1963, S. 3 (im Anhang ).
- ↑ Hugo Strunz , Ernest H. Nickel : Strunz Mineralogical Tables. Chemical-structural Mineral Classification System . 9. Auflage. E. Schweizerbart'sche Verlagsbuchhandlung (Nägele u. Obermiller), Stuttgart 2001, ISBN 3-510-65188-X , S. 35 .
- ↑ Datenblatt Blei (PDF) bei Merck , abgerufen am 23. Februar 2010.
- ↑ a b c AF Holleman , E. Wiberg , N. Wiberg : Lehrbuch der Anorganischen Chemie . 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9 .
- ↑ P. de Marcillac, N. Coron, G. Dambier, J. Leblanc, J.-P. Moalic: Experimental detection of α-particles from the radioactive decay of natural bismuth. In: Nature . 422, 2003, S. 876–878; doi:10.1038/nature01541 .
- ↑ G. Audi, O. Bersillon, J. Blachot, AH Wapstra: The NUBASE evaluation of nuclear and decay properties. In: Nuclear Physics. Band A 729. Amsterdam 2003, S. 3–128. doi : 10.1016/j.nuclphysa.2003.11.001 . ( PDF ; 1,0 MB).
- ↑ Neutrino-Jagd, Blei aus antikem Schiff schützt Hightech-Experiment. In: Spiegel Online. 19. März 2010, abgerufen: 19. März 2010.
- ↑ F. Scheiding: Über die Schutzmaassregeln bei Herstellung des Nitroglycerins. In: Angewandte Chemie . 3, 20, 1890, S. 609–613; doi:10.1002/ange.18900032002 .
- ↑ RoHS: Neue Ausnahmen von den Stoffverwendungsgeboten: RoHS: Neue Ausnahmen von den Stoffverwendungsgeboten ( Memento vom 24. März 2018 im Internet Archive ), abgerufen am 24. März 2018
- ↑ Zu viel Blei in Küchenarmaturen. auf: orf.at 19. August 2011, abgerufen am 28. April 2012.
- ↑ MAK- und BAT-Werte-Liste 2017, Mitteilung 53, Senatskommission zur Prüfung gesundheitsschädlicher Arbeitsstoffe , Wiley-VCH Verlag, 21. Juli 2017, ISBN 978-3-527-81211-0 , Kapitel III. Krebserzeugende Arbeitsstoffe ( doi : 10.1002/9783527812110.ch3 , freier Volltext) und MAK- und BAT-Werte-Liste 2017 ( doi : 10.1002/9783527812110.oth , freier Volltext).
- ↑ Katja Bauer: Giftstoffe auf Schießständen von Elitepolizisten? auf: badische-zeitung.de , 4. Juni 2016, (4. Juni 2016)
- ↑ Sportschützen sollen bleifreie Munition benutzen. In: badische-zeitung.de , Panorama. 9. Juni 2016. (11. Juni 2016)
- ↑ F. Scheffer, P. Schachtschabel: Lehrbuch der Bodenkunde. 13. Auflage. Enke Verlag, Stuttgart 1992, ISBN 3-432-84772-6 , Kap. XXII 4 d.
- ↑ Umweltdaten (S. 31). (PDF; 4,1 MB).
- ↑ Bleischrot und Umwelt, Nabu; Kreisverband Aachen .
- ↑ Jagd mit Bleimunition, SWR .
- ↑ Carvalho FM, Neto AM, Peres MF, et al: Intoxicação pelo chumbo: Zinco protoporfirina no sangue de crianças de Santo Amaro da Purificação e de Salvador , J Pediatr (Rio J). 1996;72(5):295‐298. doi:10.2223/jped.629
- ↑ Umweltdaten (S. 28 und 35). (PDF; 4,1 MB).
- ↑ Schwermetalle in Lebensmitteln: Schwermetalle in Lebensmitteln , abgerufen am 24. März 2018
- ↑ Stiftung Warentest warnt vor Blei im Trinkwasser , 19. März 2010, abgerufen am 2. Januar 2013.
- ↑ Rotguss kontra Messing. ( Memento vom 28. Mai 2013 im Internet Archive ) auf: messing-sanitaer.de , abgerufen am 3. Februar 2014.
- ↑ Korrosion an metallischen Werkstoffen im Trinkwasser. auf: trinkwasserspezi.de , abgerufen am 3. Februar 2014.
- ↑ G. Jander, E. Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. 16. Auflage. S. Hirzel-Verlag, Stuttgart 2005, ISBN 3-7776-1388-6 , S. 533, 472, 540–541.
- ↑ N. Maleki, A. Safavi, Z. Ramezani: Determination of lead by hydride generation atomic absorption spectrometry (HGAAS) using a solid medium for generating hydride. In: J Anal At Spectrom . 14, 1999, S. 1227–1230; doi:10.1039/A808429G .
- ↑ M. Heisterkamp, F. Adams: In situ propylation using sodium tetrapropylborate as a fast and simplified sample preparation for the speciation analysis of organolead compounds using GC-MIP-AES. In: J. Anal. At. Spectrom. 14, 1999, S. 1307–1311; doi:10.1039/A901340G .
- ↑ M. Zougagh, A. Garcia de Torres, E. Alonso, J. Pavon: Automatic on line preconcentration and determination of lead in water by ICP-AES using a TS-microcolumn. In: Talanta . 62, 2004, S. 503–510; doi:10.1016/j.talanta.2003.08.033 .
- ↑ Z. Chen, N. Zhang, L. Zhuo, B. Tang: Catalytic kinetic methods for photometric or fluorometric determination of heavy metal ions. In: Microchim Acta . 164, 2009, S. 311–336; doi:10.1007/s00604-008-0048-8 .
- ↑ A. Townsend, K. Miller, St. McLean, St. Aldous: The determination of copper, zinc, cadmium and lead in urine by high resolution ICP-MS. In: J. Anal. At. Spectrom. 13, 1998, S. 1213–1219; doi:10.1039/A805021J .
- ↑ R. Lobinski, Z. Marczenko: Spectrochemical Trace Analysis for Metals and Metalloids. Elsevier 1997, ISBN 0-444-82879-6 .
- ↑ I. Oehme, OS Wolfbeis: Optical Sensors for Determination of Heavy Metal Ions. In: Microchim. Acta . 126, 1997, S. 177–192; doi:10.1007/BF01242319 .
- ↑ B. Lange, ZJ Vejdelek: Photometrische Analyse. Verlag Chemie, Weinheim 1980.
- ↑ Y. Bonfil, E. Kirowas-Eisner: Determination of nanomolar concentrations of lead and cadmium by anodic-stripping voltammetry at a silver electrode. In: Anal. Chim. Acta . 457, 2002, S. 285–296; (PDF) ( Memento vom 30. Januar 2012 im Internet Archive )
- ↑ J. Wang: Stripping Analysis at Bismuth Electrodes: A Review. In: Electroanalysis . 17, 2005, S. 1341–1346; doi:10.1002/elan.200403270 .
- Umweltgefährlicher Stoff
- Gesundheitsschädlicher Stoff bei Verschlucken
- Gesundheitsschädlicher Stoff bei Einatmen
- Stoff mit reproduktionstoxischer Wirkung
- Gesundheitsschädlicher Stoff (Organschäden)
- CMR-Stoff
- SVHC-Stoff
- Gruppe-14-Element
- Schwermetall
- Periode-6-Element
- Chemisches Element
- Wikipedia:Exzellent
- Mineral
- Kubisches Kristallsystem
- Elemente (Mineralklasse)
- Blei
- Beschränkter Stoff nach REACH-Anhang XVII