Virus
Virus ( entall : viruset, utenfor den fagspråket også virus, fra latin virus, naturlig viskøs fuktighet, slim, juice, [særlig:] poison ' [1] [2] ) er smittsomme organiske strukturer som vises som virioner utenom Celler (ekstracellulær) spres ved overføring, men som virus kan bare formere seg i en passende vertscelle (intracellulær). De består bare av DNA eller RNA og proteinene som lar dem komme inn i en celle. Med nukleinsyrene inneholder alle virusene "programmet" for reproduksjon og spredning (noen virus har også tilleggskomponenter), men har verken en uavhengig replikasjon eller sin egen metabolisme og er derfor avhengige av metabolismen til en vertscelle. Av denne grunn er virologer stort sett enige om ikke å inkludere virus blant levende ting . Men man kan i det minste betrakte dem som "nær liv", fordi de generelt har evnen til å kontrollere replikasjonen og evnen til å utvikle seg . [3]
I 2011 var det kjent at 1,8 millioner forskjellige nylige arter av levende vesener fungerte som verter for virus, [4] imidlertid bare rundt 9110 virusarter . [5] Virus angriper celler fra eukaryoter ( planter , sopp og dyr inkludert mennesker) samt prokaryoter ( bakterier og arkaer ). Virus som bruker prokaryoter som verter kalles bakteriofager ; for virus som spesifikt angriper archaea, brukes imidlertid noen ganger begrepet archaeophages . [6] [7]
Vitenskapen som omhandler virus og virusinfeksjoner er kjent som virologi .
Historie for leting
På midten av 1800 -tallet ble begrepet virus bare brukt synonymt for " gift " eller " miasma ". [8] Virus har bare vært kjent som en egen biologisk enhet siden slutten av 1800 -tallet. Beskrivelsene av virussykdommer er mye eldre, det samme er de første behandlingsmetodene. Fra Mesopotamia er det en lovtekst fra rundt 1780 f.Kr. Det handler om straff av en mann hvis hund, sannsynligvis smittet med rabies, biter og dreper en person ( Codex Eschnunna §§ 56 og 57). Representasjoner er kjent fra egyptiske hieroglyfer som antagelig viser konsekvensene av en polioinfeksjon .
Begrepet "virus" ble først brukt av Cornelius Aulus Celsus i det første århundre f.Kr. Brukt. Han beskrev spyttet som overførte rabies som "giftig". I 1882 ledet Adolf Mayer i eksperimenter med tobakkmosaikk sykdom først ubevisst en viral patogenoverføring ( overføring ) gjennom av saften av infiserte overførte planter til friske planter og utløste også sykdommen hos disse.
Denne overføringen ble assosiert med ordet virus allerede på 1700 -tallet. The Times of London beskriver virusinfeksjonen hans i en dødsannonse for en lege: Da han sydde et dissekert lik, stakk han hånden, "som introduserte noe av virusmaterialet, eller med andre ord inokulerte ham med surhet" (hvorved en lite virussubstans ble overført, eller med andre ord, forrådnelse ble inokulert). [9]
Uavhengig av Mayer demonstrerte Dimitri Iwanowski i et eksperiment i 1892 at mosaikksykdommen i tobakksplanter kan utløses av et stoff som ikke kunne fjernes ved filtrering ved hjelp av et bakteriesikkert filter ( Chamberland- filter) og hvis partikler derfor er vesentlig mindre enn bakterier måtte. Ivanovsky mistenkte at gift var årsaken til sykdommen. Martinus Willem Beijerinck motsatte dette etter å ha observert at bladene som fremdeles vokste ble spesielt påvirket av sykdommen: "Selv om en gift også ville trenge inn i de eksisterende cellene, trenger virusene åpenbart celledeling for å utvikle seg." [10]
Det første beviset på et animalsk virus ble laget i 1898 av Friedrich Loeffler og Paul Frosch , som oppdaget munn- og klovsykeviruset (se også virologisk diagnostikk ). Størrelsen på mange virus ble bestemt på 1930 -tallet av William Joseph Elford ved bruk av ultrafiltreringsmetoder .
Det tidligere eldste - indirekte - beviset på en forårsaket av virussykdom ble hentet gammelt fra deformerte beinene til en 150 millioner år liten tobeint dinosaur (Dysalotosaurus lettowvorbecki) fra Berlin Museum of Natural History er lagret og symptomer på Pagets sykdom bein har, på en paramyxovirusinfeksjon . [11]
eiendommer
Virus har DNA eller RNA som bærer genetisk informasjon. Men de har ingen metabolisme, kan ikke omdanne energi og er ikke i stand til å bygge proteiner. Dannelsen av disse strukturene og deres multiplikasjon er imidlertid mulig under visse omstendigheter med den fungerende metabolismen i cellen til et levende vesen . Informasjonen som kreves for dette, spesielt for proteinsyntese , bæres av viruset på nukleinsyren ( DNA eller RNA ). I hovedsak er et virus en nukleinsyre hvis informasjon kan kontrollere metabolismen til en vertscelle på en slik måte at virus dukker opp igjen. Replikasjonen av virusnukleinsyren finner sted i vertscellen, det samme gjør strukturen av virusproteiner av ribosomer i cellens cytoplasma for ytterligere å utstyre viruspartiklene (virionene). Lipidene i en hvilken som helst virushylster av virionen kommer også fra vertscellen.
Virus kommer i to former:
- Først som en nukleinsyre i vertens celler. Nukleinsyren inneholder informasjonen for replikasjon og reproduksjon av den andre virusformen. I denne formen skilles det mellom DNA -virus og RNA -virus , avhengig av om deres genetiske materiale er lagret som DNA eller som RNA.
- For det andre, som en virion som skilles ut fra vertscellene og gjør at den kan spre seg til andre verter.
Når det gjelder spredning og effekt i deres respektive reservoarvert og muligens også mellomliggende vert, varierer typer virus ofte veldig tydelig fra hverandre når det gjelder egenskapene til smittsomhet , smittsomhet og patogenitet eller virulens .
Generelt, på grunn av den høyere feilraten for RNA-polymeraser , er RNA-virus mye mer variabelt enn DNA-virus ,[12] siden deres RNA-polymerase vanligvis ikke har noen korrekturlesende eksonukleasefunksjon . [13] [14] [15] Et unntak er nidovirales , som har en korrekturlesingsfunksjon med eksoribonukleasen ExoN , noe som betyr at genomstørrelsen er noe mindre begrenset. [16] På grunn av den høye mutasjonshastigheten produserer RNA-virus mer defekte, ikke-smittsomme viruspartikler, som kalles kondisjonskostnader på grunn av redusert funksjonalitet. Imidlertid kan de også tilpasse seg raskere til nye verter eller mellomliggende verter i løpet av en immununndragelse og unnslippe immunresponsen gjennom fluktmutasjon . [17]
Kjennetegn ved virioner
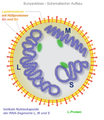
En viruspartikkel utenfor cellene kalles en virion (flertall viria, virioner). Virioner er partikler som inneholder nukleinsyrer - enten deoksyribonukleinsyrer (DNA) eller ribonukleinsyrer (RNA) - og vanligvis har en omsluttende proteinkapsel ( kapsid ). Imidlertid mangler en kapsel f.eks. B. influensaviruset , som i stedet har et ribonukleoprotein . Noen virioner er også innhyllet av en biomembran, hvor lipidbilaget er ispedd virale membranproteiner . Dette er kjent som viruskonvolutten . Virus som midlertidig har en virushylster i tillegg til kapsidet frem til begynnelsen av replikasjonsfasen omtales som innhyllet , virus uten en slik konvolutt blir referert til som ikke-innhyllet . Noen virioner har andre tilleggskomponenter.
Diameteren på virioner er omtrent 15 nm (for eksempel Circoviridae ) til 440 nm ( Megavirus chilensis ). Virioner er betydelig mindre enn bakterier, men noe større enn viroider , som verken har et kapsid- eller virushylster.
Proteinkapsidet kan ha forskjellige former, for eksempel icosahedral , isometrisk, spiralformet eller kuleformet .
Serologisk skillbare variasjoner av et virus kalles serotyper .
Virioner brukes til å spre virus. De trenger helt eller delvis (i det minste nukleinsyren) inn i vertscellene (infiserer dem). Etter det begynner vertens metabolisme å multiplisere virusnukleinsyren og de andre virionkomponentene produseres.
Systematisk posisjon
Virus er egentlig bare materielle programmer for egen reproduksjon i form av en nukleinsyre. Selv om de har spesifikk genetisk informasjon, har de ikke synteseutstyret som er nødvendig for replikasjonen. Om virus kan kalles levende vesener, avhenger av definisjonen på liv . En allment anerkjent, uimotsagt definisjon eksisterer ennå ikke. De fleste forskere klassifiserer ikke virus som levende vesener - selv om den vitenskapelige diskusjonen ennå ikke er fullført, [18] siden for eksempel genomstørrelsen på Cafeteria roenbergensis -viruset begynner å sløre en avgrensning basert på genomets størrelse. [19]
Virus regnes vanligvis ikke blant parasittene , fordi parasitter er levende ting. Noen forskere betrakter fortsatt virus som parasitter fordi de infiserer en vertsorganisme og bruker stoffskiftet til sin egen reproduksjon. Disse forskerne definerer virus som "obligatoriske intracellulære parasitter" (livsformer som alltid er parasitter i en celle) som består av minst ett genom og som krever at en vertscelle replikeres. Uavhengig av om de er klassifisert som levende vesener eller ikke-levende vesener, kan man være enig i at atferden til virus er veldig lik den for vanlige parasitter. Virus, som prioner , funksjonsløse DNA -sekvenser og transposoner , kan beskrives som "parasittiske" i denne forstand.
Multiplikasjon og spredning
Et virus i seg selv er ikke i stand til noen metabolske prosesser , så det trenger vertsceller for å reprodusere . Replikasjonssyklusen til et virus begynner vanligvis når et virion fester (adsorpsjon) til et overflateprotein på en vertscelle som viruset bruker som reseptor . Når det gjelder bakteriofager, gjøres dette ved å injisere dets genetiske materiale i en celle; for eukaryoter blir virionene omvendt av endocytose og trenger deretter inn i endosomhinnen , f.eks. B. av et fusogent protein . Etter absorpsjon må en virion først frigjøres fra konvoluttene (ubelegg) før replikering. Virusets genetiske materiale, dets nukleinsyre, replikeres deretter i vertscellen, og konvoluttproteinene og muligens andre komponenter i virionene blir også syntetisert av vertscellen ved å bruke genene til virusgenomet ( proteinbiosyntese / genuttrykk) . Således dannes nye celler i cellen ( morfogenese ), frigjøres som virioner, enten ved at cellemembranen oppløses ( cellelyse , lytisk virusreplikasjon), eller utslipp av ( utskilt ) blir (virus spirende, spirende) med deler cellemembranen som en del av virushylsteret . Ved hjelp av immunevasiner undertrykkes vertens immunforsvar. Antallet nydannede virioner i en infisert vertscelle kalles burst -størrelsen .
En annen mulighet er integrering av virusgenomet i vertens ( provirus ). Dette er tilfellet med tempererte virus som bakteriofagen lambda .
Effekten av virusreplikasjon på vertscellen kalles den cytopatiske effekten (CPE), effekten på hele vertsorganismen kalles virussykdom eller virose . Det finnes forskjellige typer cytopatisk effekt: cellelyse , pyknose ( poliovirus ), cellefusjon ( meslingervirus , herpes simplexvirus, parainfluensavirus ), intranukleære inneslutninger ( adenovirus , meslingervirus), intraplasmiske inneslutninger ( rabiesvirus , koppevirus ).
Virus kan spres på mange måter. For eksempel kan virus som er patogene for mennesker overføres via luften ved hjelp av dråpeinfeksjon (f.eks. Influensavirus) eller via forurensede overflater ved smøreinfeksjon (f.eks. Herpes simplex ). Plantevirus overføres ofte av insekter eller ved mekanisk overføring mellom to planter eller via forurensede verktøy i landbruket. Et abstrakt syn på den epidemiologiske kinetikken til virus og andre patogener er utviklet i teoretisk biologi .
utvikling
opprinnelse
Opprinnelsen til virusene er ukjent. De fleste forskere i dag antar at virus ikke er forløpere for celleliv, men snarere gener av levende ting som brøt løs fra levende ting. Flere muligheter diskuteres fortsatt, hvor det i utgangspunktet er to forskjellige tilnærminger:
- Virus er veldig primal; de oppsto før den første cellen og i den kjemiske "urssuppen" som produserte selv de mest primitive livsformene; med RNA- genomer er de en restover fra pre-DNA-verdenen. Denne tilnærmingen ble for eksempel representert av Félix Hubert d'Hérelle (1924) og Salvador Edward Luria (1960) [20] .
- Virus er en slags tilbakegang for komplette organismer som allerede eksisterte da de ble dannet.
Fra dette er tre teorier formulert.
- Avledet fra selvrepliserende molekyler (coevolution). Denne teorien antar at opprinnelsen og utviklingen av virus startet fra de enkleste molekylene som til og med var i stand til å doble seg selv. Da ville noen slike molekyler til slutt ha samlet seg for å danne organisatoriske enheter som kan sees på som celler. Samtidig lyktes andre molekyler i å pakke seg inn i viruspartikler, som fortsatte å utvikle seg parallelt med cellene og ble deres parasitter. [21]
- Virusutvikling gjennom degenerasjon ( parasitt ). Denne teorien er basert på den andre mulige tilnærmingen som ble presentert ovenfor, ifølge hvilken de første virusene opprinnelig kom fra frittlevende organismer som bakterier (eller hypotetiske ribocytter ), som sakte og kontinuerlig mistet mer og mer av sin genetiske informasjon til de til slutt ble celleparasitter, som er avhengige av en vertscelle for å gi dem funksjonene som har gått tapt. Et konsept som øker oppmerksomheten i denne sammenhengen (den for Virozelle English virocell): Den faktiske fenotypen til et virus den infiserte cellen, virionen (viruspartikler), men bare ett trinn i reproduksjonen eller distribusjonen, som ligner på pollen eller sporer . [22] [23]
- Virusdannelse fra vertscellens egne RNA- eller DNA -molekyler. Denne tredje teorien, som ser ut til å være den mest sannsynlige for forskning, sier at virus dukket opp direkte fra vertscellens RNA eller DNA -molekyler. Som det genetiske materialet til virus har disse nukleinsyrene som har blitt uavhengige fått evnen til å multiplisere uavhengig av vertscellens genom eller dets RNA, men til slutt har de forblitt parasitter ( S. Luria , 1960). [24] [25] Eksempler på mulige overgangsformer er transposoner og retrotransposoner .
variasjon
For utviklingen av et virus (eller et hvilket som helst gen) er variabilitet og utvalg det viktig. Variabiliteten skyldes (som med alle organismer) kopieringsfeil i replikasjonen av arvematerialet og brukes blant annet til immununndragelse og endring av vertsspekteret , mens utvelgelsen ofte utføres av vertens (immun) respons.
Mer høyt organiserte levende vesener har utviklet en svært effektiv mulighet for genetisk variasjon gjennom rekombinasjon og overgang i seksuell reproduksjon, spesielt i retning av miljøtilpasning og dermed videreutvikling av deres respektive arter. Virioner eller virus, som strukturer som er i stand til å overleve og som er avhengige av levende verter for deres reproduksjon og dermed også sprer seg, uten seksuell reproduksjon alene med deres evne til å mutere, viser minst en like mulighet for genetisk variasjon.
Det er da til syvende og sist irrelevant at disse mutasjonene i virusgenomet i hovedsak er basert på kopieringsfeil under replikasjon i vertscellene. Det eneste som teller er den positive effekten av den ekstreme økningen i tilpasningsevne som følge av bevaring av arten. Selv om slike feil kan føre til celledød i for eksempel en høyt utviklet pattedyrcelle, har de faktisk en stor seleksjonsfordel for virus.
Kopieringsfeil ved replikasjon uttrykkes i punktmutasjoner , dvs. ved inkorporering av feil baser på tilfeldige genlokasjoner . Siden virus, i motsetning til de mer høyt utviklede cellene, har få eller ingen reparasjonsmekanismer, blir disse feilene ikke korrigert.
Spesielle former for genetisk endring i virus er beskrevet i detalj der, for eksempel når det gjelder influensavirus , ved å bruke begrepene antigen drift og antigen shift (genetisk assortiment ).
Vertsreaksjoner
Virusinfeksjon skaper forskjellige former for forsvarssvar hos vertene . Virus replikeres bare intracellulært fordi de bruker nødvendige byggesteiner og enzymer fra cytosolen til en vertscelle for replikasjon . Derfor har det dukket opp forskjellige intracellulære forsvarsmekanismer, som er kjent som restriksjons- eller motstandsfaktorer . Mens bakterier inkludert CRISPR og restriksjonsenzymer for å avverge bruk av bakteriofager i en celle, er det slike eukaryoter . B. den myxoviruset motstandsfaktoren Mx1 de PAMP reseptorer , den dsRNA-aktiverte inhibitor av oversettelses DAI, den melanom differensieringsantigen 5 ( MDA-5 ), den oligoadenylat- syntase OAS1 , den Langerin , den tetherin , SAM domene og HD-domene 1 protein ( SAMHD1 ), RIG-I , APOBEC3 , TRIM5alpha , proteinkinase R og RNA-interferens .
Hos dyr, spesielt virveldyr, har det utviklet seg en ekstra immunrespons . Det er delvis medfødt , delvis ervervet . I løpet av den ervervede eller adaptive immunresponsen dannes antistoffer og cytotoksiske T -celler som kan binde individuelle komponenter i viruset ( antigener ). Dette gjør dem i stand til å gjenkjenne og eliminere virus og virusinfiserte celler.
Samevolusjon
En observasjon i patogenesen hos naturlige verter er at patogener tilpasset verten vanligvis ikke skader det veldig mye, siden de trenger det for sin egen utvikling og immunsystemet aktiveres av celleskader og apoptose . Å unngå en immunreaksjon letter replikasjon og overføring (synonymt med overføring ) til andre verter. Noen virus forblir i kroppen for livet. Gjenaktivering kan forekomme fra tid til annen, selv uten symptomer. (Se også: Patogen -persistens .) For eksempel når herpes simplex -virus infeksjonshastigheter (synonymt med forurensning ) hos over 90% av den tyske befolkningen med mindre uttalte symptomer. Det simianske immunsviktviruset produserer ikke AIDS i sine naturlige verter, i motsetning til HIV hos mennesker. I kontrast er infeksjoner med Ebola-virus hos mennesker, men ikke i deres naturlige verter, tidvis selvslukkende på grunn av deres høye virulens før effektiv overføring finner sted, siden verten er sterkt svekket og snart dør, følgelig bevegelsesområdet og dermed spredningen av viruset begrenset. Et alvorlig smitteforløp med høy dødelighet (se dødelighet og dødelighet ) er vanligvis en indikasjon på at det forårsakende patogenet ennå ikke har tilpasset seg organismen som reservoarvert. Overgangen fra patogener med et høyt replikasjonsnivå (og skade forårsaket) til en permanent infeksjonshastighet ( Smitt og vedvar , unngå skader) er imidlertid flytende. Med andre ord har tilpassede smittsomme objekter en tendens til å vedvare og ha en regulert reproduksjonshastighet , mens mindre tilpassede patogener har en tendens til å føre til for tidlig avslutning av infeksjonskjeden . [26] [27] [28] Unntak er z. B. H5N1 -virus hos fugler, Yersinia pestis og humane koppevirus hos mennesker. Imidlertid skjer tilpasningen vanligvis fra vertens side, siden patogenene er i konkurranse med sine spesifikasjoner og et mindre reproduktivt patogen ville fortapes raskere. [29] Derfor skjer en reduksjon i patogenisitet hos patogener først og fremst i forbindelse med en økt reproduksjonshastighet. [26]
Tilpasningen av verten til patogenet omtales som vertsbegrensning eller resistens. De kjente antivirale og antibakterielle mekanismene inkluderer, som allerede forklart under vertsreaksjoner i eukaryoter, hos mennesker, for eksempel myxovirusresistensfaktoren Mx1 , PAMP-reseptorene , den dsRNA-aktiverte translasjonshemmeren DAI, MDA5 , oligoadenylatsyntasen OAS1 , langerin , tetherin , APOBEC3 , TRIM5alpha og proteinkinase R. I tillegg finner immunresponsen sted.
Klassifisering
Konvensjonell virusklassifisering
I 1962 introduserte André Lwoff , Robert W. Horne og Paul Tournier en virustaxonomi ("LHT -system") basert på den binære klassifiseringen av levende ting etablert av Carl von Linné , som inkluderer følgende nivåer (mønster for endene av taxa i Braketter):
-
Virosphere ( phylum : Vira)
-
Subphylum (... vira)
-
Klasse (biologi) (... ica)
-
Bestill (... viral)
-
Familie (... viridae)
-
Underfamilie (... virinae)
-
Slekt eller slekt (... virus)
-
Arter eller arter (i henhold til
... virus forårsaket)
-
Arter eller arter (i henhold til
-
Slekt eller slekt (... virus)
-
Underfamilie (... virinae)
-
Familie (... viridae)
-
Bestill (... viral)
-
Klasse (biologi) (... ica)
-
Subphylum (... vira)
Dette ledsages av en oppgave i grupper som er basert på vertene
- Bakterier og arkaer (angrep av bakteriofager / arkeofager)
- Alger , sopp og protozoer
- Planter (angrep også av viroider )
- Dyr, med tre undergrupper:
- virvelløse dyr (virvelløse dyr)
- Virveldyr (virveldyr)
- Representanter for begge gruppene
De fleste virus tilhører bare en av de fire ovennevnte gruppene, men virusarter i familiene Rhabdoviridae og Bunyaviridae kan infisere både planter og dyr. Noen virus formerer seg bare hos virveldyr, men overføres også mekanisk av virvelløse dyr (se vektor ), spesielt av insekter . Virus som er avhengige av bruk av gener fra andre virus (mumivirus) under felles infeksjon i en vertscelle kalles virofager .
Virustaxonomi ifølge ICTV
Den internasjonale komiteen for taksonomi for virus (ICTV) har utviklet et klassifiseringssystem for å sikre en enhetlig inndeling i familier. Den niende ICTV -rapporten definerer et konsept med virusartene som den laveste taksonen i et hierarkisk system med forgrening av virustaxa. [30]
Fram til 2017 var den taksonomiske strukturen i utgangspunktet den samme som for den konvensjonelle virusklassifiseringen fra nivårekkefølge og under (se ovenfor) og ble i 2018 supplert med ytterligere nivåer som følger (med navneavslutninger annerledes enn LHC -systemet): [31] [ 32]
-
Område (en. Realm) ( ... viria )
-
Delområde (en. Subrealm) ( ... vira ) (slutter som med Subphylum i LHC-systemet, som det nest øverste nivået)
-
Reich (en. Kingdom) ( ... virae )
-
Unterreich (en. Subkingdom) ( ... virites )
-
Trunk eller phylum ( ... viricota ) (i analogi med ... archaeota - forskjellig fra LHC -systemet er flere virusfylum mulige)
-
Subphylum ( ... viricotina )
-
Klasse ( ... viricetes )
-
Underklasse ( ... viricetidae )
-
Bestill ( ... viral )
-
Underordning ( ... virineae )
-
Familie ( ... viridae )
-
Underfamilie ( ... virinae )
-
Slekt eller slekt ( ... virus )
-
Subgenus or subgenus ( ... virus )
- Arter eller arter ( ... virus )
-
Subgenus or subgenus ( ... virus )
-
Slekt eller slekt ( ... virus )
-
Underfamilie ( ... virinae )
-
Familie ( ... viridae )
-
Underordning ( ... virineae )
-
Bestill ( ... viral )
-
Underklasse ( ... viricetidae )
-
Klasse ( ... viricetes )
-
Subphylum ( ... viricotina )
-
Trunk eller phylum ( ... viricota ) (i analogi med ... archaeota - forskjellig fra LHC -systemet er flere virusfylum mulige)
-
Unterreich (en. Subkingdom) ( ... virites )
-
Reich (en. Kingdom) ( ... virae )
-
Delområde (en. Subrealm) ( ... vira ) (slutter som med Subphylum i LHC-systemet, som det nest øverste nivået)
Av disse tillatte nivåene så langt (ICTV -status februar 2019) er det bare areal, fylum, undergruppe, klasse, orden, underordning, familie, underfamilie, slekt, underslekt og arter som er i faktisk bruk. Es gibt in diesen Richtlinien keine Definition von Unterarten (Subspecies), Stämmen (im Sinn von Varietäten, wie „Bakterienstamm“, englisch: strain) oder Isolaten . Die Namensendungen aller Rangstufen haben also „vir“ als Bestandteil (aber nicht in der Form „viroid“); die Abkürzungen enden auf „V“, ggf. gefolgt von einer Nummer (nicht römisch, sondern arabisch). Für Viroide und Satelliten als subvirale Partikel kann eine analoge Taxonomie mit jeweils eigenen Namensendungen mit charakterisierendem Bestandteil verwendet werden.
Mit Stand von März 2019 wurden die folgenden Ordnungen aufgenommen: [33]
Zum Phylum Negarnaviricota :
- Muvirales
- Serpentovirales
- Jingchuvirales
- Mononegavirales
- Goujianvirales
- Bunyavirales
- Articulavirales
Weitere Ordnungen und Unterordnungen der Riboviria :
- Nidovirales
-
- Abnidovirineae
- Arnidovirineae
- Cornidovirineae
- Mesnidovirineae
- Monidovirineae
- Ronidovirineae
- Tornidovirineae
- Picornavirales
- Tymovirales
Nicht in höhere Ränge gruppierte Ordnungen:
- Caudovirales
- Herpesvirales
- Ligamenvirales
- Ortervirales
Die Baltimore-Klassifikation
Die vom Nobelpreisträger und Biologen David Baltimore vorgeschlagene Klassifizierung basiert darauf, in welcher Form genau das Virusgenom vorliegt und wie daraus die Boten-RNA ( mRNA ) erzeugt wird. Das Virus-Genom kann in der Form von DNA oder RNA vorliegen, Einzelstrang (englisch: single-stranded, ss) oder Doppelstrang (englisch double-stranded, ds). Ein Einzelstrang kann als Original (englisch: sense, +) oder in komplementärer Form (englisch: antisense, −) vorliegen. Unter Umständen wird zur Vervielfältigung ein RNA-Genom übergangsweise in DNA umgesetzt ( Retroviren ) oder umgekehrt ein DNA-Genom übergangsweise in RNA transkribiert ( Pararetroviren ); in beiden Fällen wird die RNA mit einer Reversen Transkriptase (RT) in DNA zurückgeschrieben.
Die gesamte Virosphäre wird durch folgende sieben Gruppen definiert:
- I: dsDNA-Viren (dazu Adenoviren , Herpesviren , Riesenviren , Pockenviren )
- II: ssDNA-Viren (+ Strang) DNA (dazu Parvoviren )
- III: dsRNA-Viren (dazu Reoviren )
- IV: (+)ssRNA-Viren (+ Strang) RNA (dazu Picornaviren , Togaviren )
- V: (−)ssRNA-Viren (− Strang) RNA (dazu Orthomyxoviren , Rhabdoviren )
- VI: ssRNA-RT-Viren (+ Strang) – RNA mit DNA-Zwischenstadium ( Retroviren )
- VII: dsDNA-RT-Viren – DNA mit RNA-Zwischenstadium ( Pararetroviren , dazu Hepadnaviren )
Moderne Virusklassifikationen benutzen eine Kombination von ICTV und Baltimore.
Schreibweise der Virusartnamen
Der offizielle internationale, wissenschaftliche Name eines Virus ist die englischsprachige Bezeichnung, nach der sich stets auch die international gebräuchliche Abkürzung richtet, wie bei Lagos bat virus (LBV). Diese Abkürzung wird unverändert auch im Deutschen verwendet. Folgerichtig lautet die Abkürzung für die deutsche Virusbezeichnung Lagos-Fledermaus-Virus ebenfalls LBV .
In den englischen Virusnamen wie zum Beispiel bei West Nile virus werden normalerweise keine Bindestriche benutzt und virus wird kleingeschrieben. Der Bindestrich taucht im Englischen nur bei Adjektiven auf, also bei Tick-borne encephalitis virus oder Avian encephalomyelitis-like virus .
Im Deutschen werden die Virusnamen teilweise mit Bindestrichen geschrieben , also West-Nil-Virus , Hepatitis-C-Virus , Humanes Herpes-Virus , Lagos-Fledermaus-Virus , Europäisches Fledermaus-Lyssa-Virus , teilweise auch zusammen. [34] [35] Vor den Nummern von Subtypen steht (wie im Englischen) ein Leerzeichen , bei den Abkürzungen ein Bindestrich, z. B. Europäisches Fledermaus-Lyssa-Virus 1 (EBLV-1), Herpes-simplex-Virus 1 (HSV-1) und Humanes Herpes-Virus 1 (HHV-1). [36]
Im Gegensatz zur belebten Welt werden nach den Regeln des ICTV auch die Namen der höheren Taxa (wie Familie , Ordnung , Klasse , Phylum (Abteilung) etc. kursiv geschrieben. Sie werden gewöhnlich nicht übersetzt. Im Gegensatz dazu werden Bezeichnungen für Subtypen ( Stämme – im Sinn von englisch strains ) – und Isolate) nie kursiv gesetzt (auch nicht evtl. darin enthaltene Gattungs- und/oder Artnamen ihrer Wirte). [37]
Werden häufig gebrauchte Namen einmal doch übersetzt (wie Coronaviren für Coronaviridae ), dann werden diese Bezeichnungen nicht kursiv gesetzt. Da sich oft Taxa in aufsteigender Rangfolge nur durch die Endung unterscheiden (wie Herpesviridae und Herpesvirales ), entstehen allerdings bei der Verwendung eingedeutschter Namen (hier: Herpesviren) oft Mehrdeutigkeiten. Das gilt auch für die Verwendung solcher Namen (z. B. Coronaviren für die prominentesten Vertreter wie SARS-CoV-2 ).
Humanpathogene Viren und ausgelöste Erkrankungen
Beim Menschen können eine Vielzahl von Krankheiten durch Viren verursacht werden. Allein diese humanpathogenen Viren sind hier hinsichtlich Genom und Behüllung klassifiziert und in ihrer Taxonomie nach ICTV aufgelistet.
Behüllte Viren
Doppelsträngige DNA-Viren = dsDNA
- Familie Poxviridae
- Unterfamilie Chordopoxvirinae
- Gattung Orthopoxvirus
- Orthopoxvirus variola = Variolavirus – Pocken , Echte Pocken
- Orthopoxvirus variola var. alastrim = Kaffernpockenvirus – Pocken , Weiße Pocken
- Monkeypoxvirus (MPV) = Orthopoxvirus simiae – Affenpocken ; auch auf den Menschen übertragbar, Symptome wie bei Menschenpocken, aber deutlich milder
- Gattung Parapoxvirus
- Parapoxvirus ovis = Orf-Virus – Orf
- Gattung Molluscipoxvirus
- Molluscum-Contagiosum-Virus – Dellwarze ( Molluscum contagiosum )
- Gattung Orthopoxvirus
- Unterfamilie Chordopoxvirinae
- Familie Herpesviridae
- Unterfamilie Alphaherpesvirinae
- Gattung Simplexvirus
- Herpes-simplex-Virus 1 (HSV-1) = Humanes Herpes-Virus 1 (HHV-1) – Herpes simplex , Herpes labialis , Stomatitis aphtosa
- Herpes-simplex-Virus 2 (HSV-2) = Humanes Herpes-Virus 2 (HHV-2) – Herpes simplex , Herpes genitalis
- Herpes-B-Virus = ( Herpesvirus simiae )
- Gattung Varicellovirus
- Varizella-Zoster-Virus (VZV) = Humanes Herpes-Virus 3 (HHV-3) – Windpocken = Varizellen (Herpes zoster), Gürtelrose
- suid Herpesvirus Typ 1 (SHV-1) = Pseudowut-Virus , Aujeszky-Virus ua – Aujeszkysche Krankheit = Pseudowut, Juckseuche, Tollkrätze ua (bei Tieren, mit geringer Pathogenität auch auf den Menschen übertragbar)
- Gattung Simplexvirus
- Unterfamilie Betaherpesvirinae
- Gattung Cytomegalovirus
- Humanes Cytomegalievirus (HCMV) = Humanes Zytomegalievirus (HZMV) = Humanes Herpes-Virus 5 (HHV-5) – Zytomegalie
- Gattung Reseolovirus
- Humanes Herpesvirus 6 (HHV-6) – Drei-Tage-Fieber
- Humanes Herpesvirus 7 (HHV-7) – Drei-Tage-Fieber
- Gattung Cytomegalovirus
- Unterfamilie Gammaherpesvirinae
- Gattung Lymphocryptovirus
- Epstein-Barr-Virus (EBV) = Humanes Herpes-Virus 4 (HHV-4) – Pfeiffer-Drüsenfieber , Burkitt-Lymphom
- Gattung Rhadinovirus
- Humanes Herpes-Virus 8 (HHV-8) – Kaposi-Sarkom
- Gattung Lymphocryptovirus
- Unterfamilie Alphaherpesvirinae
- Familie Hepadnaviridae
- Gattung Orthohepadnavirus
- Hepatitis-B-Virus (HBV) – Hepatitis B
- Gattung Orthohepadnavirus
Einzel(+)-Strang-RNA-Viren = ss(+)RNA
- Familie Togaviridae
- Gattung Alphavirus – Erreger von Arbovirosen
- Barmah-Forest-Virus – Barmah-Forest-Fieber mit grippeähnlichen Symptomen [38] , epidemische Polyarthritis [39]
- Chikungunya-Virus (CHIKV) – Chikungunya-Fieber
- Eastern-Equine-Encephalitis-Virus (EEEV) = Östliches-Pferdeenzephalitis-Virus – Übertragung durch Stechmücken auch auf den Menschen möglich (selten!) → Östliche Pferdeenzephalomyelitis ( Enzephalitis / Enzephalomyelitis ) [40]
- Western-Equine-Encephalitis-Virus (WEEV) = Westliches-Pferdeenzephalitis-Virus – Übertragung durch Stechmücken auch auf den Menschen möglich (selten!) → Westliche Pferdeenzephalomyelitis ( Enzephalitis / Enzephalomyelitis ) [41]
- Everglades-Virus – Everglades-Fieber
- O'nyong-nyong-Virus (ONNV) – O'nyong-nyong-Fieber
- Mayaro-Fieber-Virus (MAYV) – Mayaro-Fieber
- Semliki-Forest-Virus (SFV) – Semliki-Forest-Fieber
- Mucambo-Virus – Mucambo-Fieber
- Ross-River-Virus (RRV) – Ross-River-Fieber
- Sindbis-Virus (SINV) – Sindbis-Fieber (Gelenkentzündung [„epidemische Polyarthritis “], zum Teil mit Hautausschlägen und selten mit Enzephalitis )
- Gattung Rubiviren
- Rubivirus = Rötelnvirus = Rubellavirus (RUBV) – Röteln
- Gattung Alphavirus – Erreger von Arbovirosen
- Familie Flaviviridae
- Gattung Hepacivirus
- Hepatitis-C-Virus (HCV) – Hepatitis C
- GB-Virus-C (ohne Krankheitswert)
- Gattung Flavivirus
- West-Nil-Virus (WNV) – West-Nil-Fieber
- Dengue-Virus (DENV) – Dengue-Fieber
- Gelbfieber-Virus (YFV) – Gelbfieber
- Louping-ill-Virus (LIV) – Louping-ill- Enzephalitis
- St.-Louis-Enzephalitis-Virus (SLEV) – St.-Louis- Enzephalitis
- Japan-Enzephalitis-Virus (JEV) – Japanische Enzephalitis
- Usutu-Virus (USUV) – unspezifische Symptome wie Fieber und/oder Hautausschläge
- Kyasanur-Forest-Disease-Virus (KFDV) – Kyasanur-Wald-Fieber
- Powassan-Virus (POWV) – Powassan- Enzephalitis
-
FSME-Virus [englisch: tick-borne encephalitic virus (TBEV)] – FSME (Frühsommer-Meningoenzephalitis)
- Subtyp European / Western tick-borne encephalitis virus (WTBEV)
- Subtyp Siberian tick-borne encephalitis virus (STBEV)
- Subtyp Far-Eastern tick-borne encephalitis virus (Far-Eastern TBEV); ehemals Russian-Spring-Summer-Enzephalitis-Virus (RSSEV) – RSSE , auch RFSE (Russian-Spring-Summer- Enzephalitis , Russische Frühsommerenzephalitis)
- Zika-Virus (ZIKV) (2 Hauptgruppen; diverse Subtypen) – meist nur Hautausschlag, Fieber, Gelenkschmerzen, Konjunktivitis
- Gattung Hepacivirus
- Familie Coronaviridae
- Unterfamilie Orthocoronavirinae
- Gattung Alphacoronavirus
- Untergattung Duvinacovirus
- Humanes Coronavirus 229E (HCoV-229E) – Erkältung
- Untergattung Setracovirus
- Humanes Coronavirus NL63 (HCoV-NL63) – Erkältung
- Untergattung Duvinacovirus
- Gattung Betacoronavirus
- Untergattung Embecovirus
- Spezies Betacoronavirus 1
- Subspezies Humanes Coronavirus OC43 (HCoV-OC43) – Erkältung; gelegentlich auch schwere Infektion der Atemwege, Pneumonie
- Spezies Humanes Coronavirus HKU1 (HCoV-HKU1) – Erkältung
- Spezies Betacoronavirus 1
- Untergattung Merbecovirus
- Middle East respiratory syndrome coronavirus (MERS-CoV) – grippeähnliche Symptome, schwere Infektion der Atemwege, Pneumonie und ggf. Nierenversagen
- Untergattung Sarbecovirus
-
SARS-assoziiertes Coronavirus (SARS-CoV) – SARS ( atypische Lungenentzündung Pneumonie ), mit Subtyp
- Subtyp SARS-CoV-2 (eng. 2019-novel Coronavirus, 2019-nCoV, bzw. Wuhan seafood market pneumonia virus) – COVID-19 : Infektion der unteren Atemwege bis zur Lungenentzündung
-
SARS-assoziiertes Coronavirus (SARS-CoV) – SARS ( atypische Lungenentzündung Pneumonie ), mit Subtyp
- Untergattung Embecovirus
- Gattung Alphacoronavirus
- Unterfamilie Torovirinae
- Gattung Torovirus
- diverse Arten – Gastroenteritis
- Gattung Torovirus
- Unterfamilie Orthocoronavirinae
- Familie Retroviridae – Einzel(+)-Strang-RNA-Viren mit dsDNA-Zwischenstufe
- Unterfamilie Orthoretrovirinae
- Gattung Deltaretrovirus
- Humanes T-lymphotropes Virus 1 (HTLV-1) – Adulte T-Zell-Leukämie , Tropische Spastische Paraparese
- Humanes T-lymphotropes Virus 2 (HTLV-2) – Leukämie (?)
- Humanes T-lymphotropes Virus 3 (HTLV-3) – unbekannt
- Humanes T-lymphotropes Virus 4 (HTLV-4) – unbekannt
- Gattung Lentivirus
- Humanes Immundefizienz-Virus Typ 1 (HIV-1) – AIDS
- Humanes Immundefizienz-Virus Typ 2 (HIV-2) – AIDS
- Gattung Deltaretrovirus
- Unterfamilie Orthoretrovirinae
Einzel(−)-Strang-RNA-Viren = ss(−)RNA
- Familie Arenaviridae
- Gattung Mammarenavirus
- Untergattung LCMV/Lassa-Komplex (Altwelt-Arenaviren)
- Lassa-Virus ( Lassa mammarenavirus / LASV) – Lassa-Fieber
- lymphozytäre-Chorio-Meningitis-Virus ( Lymphocytic choriomeningitis Virus / Lymphocytic choriomeningitis mammarenavirus / LCMV) – Lymphozytäre Choriomeningitis
- Mopeia-Virus (MOPV) - Mopeia-Fieber ( hämorrhagisches Fieber mit teilweise sehr schwerem bis tödlichem Verlauf.) [42]
- Lujo-Virus ( Lujo mammarenavirus / LUJV) - Lujo-Fieber ( hämorrhagisches Fieber )
- Untergattung Tacaribe-Komplex: (Neuwelt-Arenaviren)
- Chapare-Virus ( Chapare mammarenavirus / CHAV) – Hämorrhagisches Fieber
- Tacaribe-Virus ( Tacaribe mammarenavirus / TCRV) – Hämorrhagisches Fieber
- Junin-Virus ( Argentinian mammarenavirus / JUNV) – Junin-Fieber (argentinisches hämorrhagisches Fieber / AHF)
- Machupo-Virus ( Machupo mammarenavirus / MACV) – Machupo-Fieber (bolivianisches hämorrhagisches Fieber / BHF mit hoher Letalität.)
- Guanarito-Virus ( Guanarito mammarenavirus / GTOV) - Guanarito-Fieber (venezuelanisches hämorrhagisches Fieber / VHF)
- Sabia-Virus ( SPH 114202 virus / Brazilian mammarenavirus / Sabiá mammarenavirus / SABV) - Sabia-Fieber (brasilianisches hämorrhagisches Fieber / BzHF)
- Untergattung LCMV/Lassa-Komplex (Altwelt-Arenaviren)
- Gattung Mammarenavirus
- Familie Bornaviridae
- Gattung Orthobornavirus (früher Bornavirus )
-
Virus der Bornaschen Krankheit (engl. Borna disease virus = BoDV) – Erreger der Borna-Krankheit bei Pferden, Schafen und anderen Säugetieren, in seltenen Fällen auch auf den Menschen übertragbar – schwere ( Enzephalitiden )
- Säugetier-Bornavirus 1 (engl. Mammalian 1 orthobornavirus)
-
Säugetier-Bornavirus 2 (engl. Mammalian 2 orthobornavirus)
- Bunthörnchen-Bornavirus 1 (engl. Variegated squirrel Bornavirus 1 = VSBV-1) bei Bunthörnchen ( Sciurus variegatoides ) nachgewiesen, auch auf den Menschen übertragbar – potenziell tödlich verlaufende Encephalitis [45]
-
Virus der Bornaschen Krankheit (engl. Borna disease virus = BoDV) – Erreger der Borna-Krankheit bei Pferden, Schafen und anderen Säugetieren, in seltenen Fällen auch auf den Menschen übertragbar – schwere ( Enzephalitiden )
- Gattung Orthobornavirus (früher Bornavirus )
- Familie Bunyaviridae – Erreger von Arbovirosen
- Gattung Orthobunyavirus
- Bunyamwera-Virus (Serogruppe)
- Batai-Virus (BATV) – grippeähnliche Symptome und Hautausschläge
- California-Encephalitis-Virus (Serogruppe) – Encephalitis
- Gattung Phlebovirus
- Rift-Valley-Fieber-Virus (3 Subtypen) – Rift-Tal-Fieber
-
Sandmückenfieber-Virus (SFNV) – Sandfly fever = Sandmückenfieber
- Subtyp Karimabad-Virus (KARV)
- Subtyp Sandmückenfieber-Virus Sabin (SFNV-Sabin)
- Subtyp Teheran-Virus (THEV)
- Subtyp Toscana-Virus (TOSV) – Pappataci-Fieber
- Serotypen : Toskana (T), Sizilien (S) und Neapel (N)
- Gattung Nairovirus
-
Krim-Kongo-Fieber-Virus (Serogruppe):
- Subtyp Krim-Kongo-Hämorrhagisches-Fieber-Virus (CCHFV) – Krim-Kongo-Fieber
- Subtyp Hazara-Virus (HAZV) – Krim-Kongo-Fieber
- Subtyp Khasan-Virus (KHAV) – Krim-Kongo-Fieber
-
Krim-Kongo-Fieber-Virus (Serogruppe):
- Gattung Hantavirus
- Hantaan-Virus (4 Subtypen) – hämorrhagisches Fieber , Nephritis
- Seoul-Virus (Serogruppe) – hämorrhagisches Fieber
- Prospect-Hill-Virus (2 Subtypen) – hämorrhagisches Fieber
- Puumala-Virus (Serogruppe) – hämorrhagisches Fieber , Pneumonie , Nephritis
- Dobrava-Belgrad-Virus – hämorrhagisches Fieber
- Tula-Virus – hämorrhagisches Fieber
- Sin-Nombre-Virus (Serogruppe) – hämorrhagisches Fieber mit schwerem Lungenödem
- Gattung Orthobunyavirus
- Familie Filoviridae
- Gattung Marburg-Virus
- Lake-Victoria-Marburgvirus (Serogruppe) – Marburg-Fieber ( hämorrhagisches Fieber )
- Gattung Ebolavirus
- Zaire-Ebolavirus (ZEBOV) Serogruppe – Ebolafieber ( hämorrhagisches Fieber )
- Sudan-Ebolavirus (SEBOV) Serogruppe – Ebolafieber ( hämorrhagisches Fieber )
- Reston-Ebolavirus (REBOV) Serogruppe – nicht humanpathogen, nur bei Makaken und Schweinen hämorrhagisches Fieber
- Côte d'Ivoire-Ebolavirus (CIEBOV) Serogruppe – Ebolafieber ( hämorrhagisches Fieber )
- Bundibugyo-Ebolavirus (BEBOV) Serogruppe – Ebolafieber ( hämorrhagisches Fieber )
- Gattung Marburg-Virus
- Familie Orthomyxoviridae
- Gattung Influenzavirus A – Influenza (Grippe)
- Influenzavirus A-Variante H1N1 – Influenza (Grippe)
- Influenzavirus A-Variante H3N2 – Influenza (Grippe)
- (aviäres) Influenzavirus-A -Variante H5N1 , hoch pathogenes aviäres Influenzavirus ( HPAIV ) – „Vogelgrippe“, bei Tieren, auch auf den Menschen übertragbar, aber kaum von Mensch zu Mensch.
- Gattung Influenzavirus B – Influenza (Grippe)
- Influenzavirus B/Victoria-Linie – Influenza (Grippe)
- Influenzavirus B/Yamagata-Linie – Influenza (Grippe)
- Gattung Influenzavirus C – Influenza (Grippe)
- Gattung Influenzavirus D – Influenza (Grippe)
- Gattung Influenzavirus A – Influenza (Grippe)
- Familie Paramyxoviridae
- Gattung Avulavirus
- Humanes Parainfluenzavirus (Typ 1, 3) – Erkältung , Parainfluenza
- Gattung Morbillivirus
- Masernvirus – Masern
- Gattung Henipavirus
- Hendra-Virus , (früher Equines Morbillivirus ) – Pneumonie ; Enzephalitis
- Nipah-Virus – Pneumonie ; Enzephalitis
- Gattung Rubulaviren
- Humanes Parainfluenzavirus (Typ 2, 4) – Erkältung , Parainfluenza
- Mumpsvirus – Mumps
- Gattung Avulavirus
- Familie Pneumoviridae
- Gattung Orthopneumovirus (früher: Pneumovirus )
- Humanes Respiratorisches Synzytial-Virus (HRSV) (Typ A, B) – Atemwegsinfektion , Erkältung
- Gattung Metapneumovirus
- Humanes Metapneumovirus (HMPV) (Typ A1 bis 2, B1 bis 2) – Atemwegsinfektion , Erkältung
- Gattung Orthopneumovirus (früher: Pneumovirus )
- Familie Rhabdoviridae
- Gattung Vesiculovirus
- Vesicular-Stomatitis-Indiana-Virus (VSV) – Stomatitis vesicularis (Mundschleimhautentzündung mit Bläschenbildung) bei Tieren, auch auf den Menschen übertragbar
- Gattung Lyssavirus
- Rabiesvirus (RABV) (ehemals Genotyp 1) = Tollwutvirus – Tollwut , bei Tieren, auch auf den Menschen übertragbar
- Mokola-Virus (MOKV) (ehemals Genotyp 3) – Tollwut , bei Tieren, auch auf den Menschen übertragbar
- Duvenhage-Virus (DUVV) (ehemals Genotyp 4) – Tollwut , bei Tieren, auch auf den Menschen übertragbar
- Europäisches Fledermaus-Lyssa-Virus 1 + 2 (EBLV-1, -2) (ehemals Genotypen 5 und 6) – Tollwut , bei Tieren, auch auf den Menschen übertragbar
- Australisches Fledermaus-Lyssa-Virus (ABLV) (ehemals Genotyp 7) – Tollwut , bei Tieren, auch auf den Menschen übertragbar
- Gattung Vesiculovirus
Unbehüllte Viren
Doppelsträngige DNA-Viren = dsDNA
- Familie Adenoviridae
- Gattung Mastadenovirus
- Humane Adenoviren AF (51 Subtypen) – Schnupfen , Erkältungen , Durchfall
- Gattung Mastadenovirus
- Familie Polyomaviridae
- Gattung Polyomavirus
- BK Polyomavirus (BKPyV) = BK-Virus (BKV) = Polyomavirus hominis Typ 1 – führt bei immunsuppressiver Behandlung nach Transplantation ev. zum Verlust des Transplantates
- JC Polyomavirus (JCPyV) = JC-Virus (JCV) = Polyomavirus hominis Typ 2 – bei zellulär Immunsupprimierten ( AIDS ) zu Progressiver multifokalen Leukoenzephalopathie (PML)
- Gattung Polyomavirus
- Familie Papillomaviridae
- Gattung Papillomavirus
- Untergattung Humane Papillomviren
- diverse Humane Papillomviren (HPV) – Warzen ;
- Kondyloma-Virus 6 (HPV-6) – Feigwarzen ; sehr selten: Rezidivierende respiratorische Papillomatose (multiples, rezidivierendes Auftreten von meist gutartigen Plattenepithel papillomen im Kehlkopf bis in Luftröhre (Trachea) und Lunge. [46]
- Kondyloma-Virus 11 (HPV-11) – Feigwarzen ; sehr selten: Rezidivierende respiratorische Papillomatose (multiples, rezidivierendes Auftreten von meist gutartigen Plattenepithelpapillomen im Kehlkopf bis in Luftröhre (Trachea) und Lunge).
- Humanes Papillomvirus 16 /18 /30 … (HPV-16 /-18 /-30 …) – Zervixkarzinom (Gebärmutterhalskrebs)
- Untergattung Humane Papillomviren
- Gattung Papillomavirus
Einzelsträngige DNA-Viren = ssDNA
- Familie Parvoviridae
-
- Unterfamilie Parvovirinae
-
- Gattung Dependoparvovirus (alias Dependovirus ) [47]
-
- Spezies Adenoassoziiertes Virus A (AAV-A)
-
- Adenoassoziiertes Virus 1 bis 4 (AAV-1 bis AAV-4)
- Spezies Adenoassoziiertes Virus B (AAV-B)
-
- Adenoassoziiertes Virus 5 (AAV-5)
- Gattung Erythroparvovirus (alias Erythrovirus )
-
- Spezies Primate erythroparvovirus 1
-
- Parvovirus B19 – Ringelröteln
Doppelsträngige RNA-Viren = dsRNA
- Familie Reoviridae
- Gattung Rotavirus
- diverse Arten – Gastroenteritis mit Durchfall
- Gattung Coltivirus
- Colorado-Tick-Fever-Virus – Colorado-Zeckenfieber
- Gattung Rotavirus
Einzel(+)-Strang-RNA-Viren = ss(+)RNA
- Familie Caliciviridae
- Gattung Norovirus
-
Norovirus (NV) = Norwalk-Like-Virus (NLV)
- Humane Noroviren der Gruppen GGI, GGII und GGIV – Brechdurchfall = Gastroenteritis
-
Norovirus (NV) = Norwalk-Like-Virus (NLV)
- Gattung Sapovirus
- Sapovirus (SV) – Gastroenteritis
- Gattung Norovirus
- Familie Hepeviridae
- Gattung Hepevirus
- Hepatitis-E-Virus (HEV) – Hepatitis E
- Gattung Hepevirus
- Familie Picornaviridae
- Gattung Enterovirus
- Poliovirus Typ 1–3 – Kinderlähmung
-
Coxsackievirus A/B – von Erkältung bis Meningitis , Pankreatitis oder Myocarditis , selten auch Lähmungen
- Coxsackievirus B1 (CVB-1) bis B 6 – Erkältung
- Echovirus – Exantheme Enantheme , Infektionen des oberen Respirationstrakts ( Erkältung ), Herpangina , Myoperikarditis , verstreute (disseminierte) Infektion bei Neugeborenen, chronische Meningoenzephalitis bei immunsupprimierten Patienten, Meningitis , Enzephalitis selten Paralyse
-
Enterovirus
-
Humane Enteroviren – Erkältung
- Humanes Enterovirus 70 (EV-70) – akute hämorrhagische Konjunktivitis
- Humanes Enterovirus 71 (EV-71) – Meningoenzephalitis , Hautausschlag und Poliomyelitis ähnliches Syndrom = Hand-Fuß-Mund-Krankheit
-
Humane Enteroviren – Erkältung
- Gattung Hepatovirus
- Hepatitis-A-Virus – Hepatitis A
- Gattung Rhinovirus
-
Rhinovirus
- Humane Rhinoviren -1 A (HRV-1 A) oder 1 B bis 100 – Erkältung
-
Rhinovirus
- Gattung Enterovirus
Onkoviren
Die Gruppe der „ Onkoviren “, der wichtigsten beim Menschen krebserzeugenden (karzinogenen) Viren, ist weltweit für 10 bis 15 Prozent aller Krebserkrankungen des Menschen verantwortlich, nach Schätzung der amerikanischen Krebsgesellschaft sogar für etwa 17 % der Krebsfälle. [48] [49]
- Epstein-Barr-Virus (EBV)
- Hepatitis-B-Virus (HBV)
- Hepatitis-C-Virus (HCV)
- Humanes Papillomvirus (HPV)
- Humanes T-lymphotropes Virus 1 (HTLV-1)
- Humanes Herpesvirus 8 (HHV-8, auch Kaposi-Sarkom-Herpesvirus, KSHV)
Riesenviren
Antivirale Medikamente
Da Viren beziehungsweise Virionen im Gegensatz zu Bakterien keine Zellen sind, können sie auch nicht wie solche abgetötet werden. Es ist lediglich möglich, eine virale Infektion und die Virusvermehrung durch Virostatika zu be- oder zu verhindern. Besonders die biochemischen Vermehrungsabläufe können von Virusart zu Virusart sehr unterschiedlich sein, was die Findung eines hemmenden oder unterbindenden Wirkstoffes erschwert.
Da die Vermehrung der Viren im Inneren von normalen Zellen stattfindet und sich dort sehr eng an die zentralen biochemischen Zellmechanismen ankoppelt, müssen die in Frage kommenden antiviralen Wirkstoffe
- das Eindringen der Virionen in die Wirtszellen verhindern,
- in den Zellstoffwechsel zum Nachteil der Virusvermehrung eingreifen oder
- nach einer möglichen Virusvermehrung in den Zellen das Austreten der neuen Viren aus den Zellen unterbinden.
Andererseits müssen diese gesuchten Wirkstoffe jedoch auch für den Körperstoffwechsel, den Zellverband und/oder den internen Zellstoffwechsel insgesamt verträglich sein, da sonst nicht nur beispielsweise die Virusvermehrung in den Zellen zum Erliegen kommt, sondern schlimmstenfalls auch das (Zell-)Leben des gesamten behandelten Organismus.
Da sich diese Bedingungen sehr schwer vereinbaren lassen, bergen die bisher entwickelten antiviralen Medikamente oft das Risiko schwerer Nebenwirkungen . Diese Gratwanderung stellt die Medizin vor schwierige Aufgaben, die bislang meist ungelöst blieben.
Verschärft wird die Entwicklung von effektiven antiviralen Medikamenten außerdem durch die Entwicklung von Resistenzen der zu bekämpfenden Viren gegenüber einem einmal gefundenen, brauchbaren Wirkstoff, zu der sie auf Grund ihres extrem schnell ablaufenden Vermehrungszyklus und der biochemischen Eigenart dieser Replikation gut in der Lage sind.
Therapie mit Viren
Aktuell wird verstärkt an Therapien geforscht, bei denen Viren zur Heilung von Krankheiten eingesetzt werden. Diese Forschungen umfassen den Einsatz viraler Vektoren unter anderem als onkolytische Viren zur Bekämpfung von Tumoren , als Phagentherapie zur gezielten Infektion und Lyse von zum Teil antibiotikaresistenten Bakterien , als Impfstoff zur Prophylaxe und Therapie von Infektionskrankheiten , zur Erzeugung von induzierten pluripotenten Stammzellen [50] oder zur Gentherapie von Gendefekten .
Siehe auch
- Endogenes Retrovirus
- Extremophile
- Kategorie:Virologe
Literatur
- Ältere Literatur
- Feodor Lynen : Das Virusproblem. In: Angewandte Chemie . Band 51. Nr. 13, 1938, ISSN 0044-8249 , S. 181–185.
- Aktuelle Literatur
- Hans W. Doerr, Wolfram H. Gerlich (Hrsg.): Medizinische Virologie – Grundlagen, Diagnostik und Therapie virologischer Krankheitsbilder. Thieme, Stuttgart/ New York 2002, ISBN 3-13-113961-7 .
- Walter Doerfler: Viren. Fischer Taschenbuch Verlag, Frankfurt a. M. 2002, ISBN 3-596-15369-7 .
- Dietrich Falke , Jürgen Bohl ua: Virologie am Krankenbett: Klinik, Diagnostik, Therapie. Springer, Heidelberg ua 1998, ISBN 3-540-64261-7 . (mit Literaturangaben)
- Matthias Eckoldt Virus: Partikel, Paranoia, Pandemien. Ecowin, Salzburg/ München 2021, ISBN 978-3-7110-0275-4 .
- Dietrich Falke, Jürgen Podlech: Viren. In: Peter Reuter: Springer Lexikon Medizin. Springer, Berlin ua 2004, ISBN 3-540-20412-1 , S. 2273–2282.
- SJ Flint, LW Enquist, VR Racaniello (Hrsg.): Principles of Virology. 2. Auflage, ASM Press, Washington DC 2003, ISBN 1-55581-259-7 .
- Alfred Grafe: Viren – Parasiten unseres Lebensraumes. Springer, Berlin/ Heidelberg/ New York 1977, ISBN 3-540-08482-7 .
- David M. Knipe, Peter M. Howley et al. (Hrsg.): Fields' Virology. 2 Bände, 5. Auflage, Lippincott Williams & Wilkins, Philadelphia 2007, ISBN 978-0-7817-6060-7 (Standardwerk der Virologie).
- Arnold J. Levine : Viren: Diebe, Mörder und Piraten. Spektrum Akademischer Verlag, Heidelberg 1992, ISBN 3-86025-073-6 .
- Susanne Modrow, Dietrich Falke , Uwe Truyen: Molekulare Virologie. Eine Einführung für Biologen und Mediziner (= Spektrum-Lehrbuch ). 2. Auflage, Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1086-X .
- Stephen S. Morse: The Evolutionary Biology of Viruses. Raven Press, New York 1994, ISBN 0-7817-0119-8 .
- Sven P. Thoms: Ursprung des Lebens: wie und wann entstand Leben auf der Erde? ... (= Fischer-Taschenbücher; Fischer kompakt. ). Fischer Taschenbuch Verlag, Frankfurt a. M. 2005, ISBN 3-596-16128-2 .
- Luis P. Villarreal: Viruses and the Evolution of Life. ASM Press, Washington 2005, ISBN 1-55581-309-7 .
- Ernst-Ludwig Winnacker : Viren: Die heimlichen Herrscher. Wie Grippe, Aids und Hepatitis unsere Welt bedrohen. Eichborn, Frankfurt a. M. 1999, ISBN 3-8218-1598-1 .
- Gottfried Schuster: Viren in der Umwelt. Teubner, Stuttgart 1998, ISBN 3-519-00209-4 .
- Dorothy H. Crawford: The invisible enemy: a natural history of viruses. Oxford University Press, Oxford 2002, ISBN 0-19-856481-3 .
- Brian W. Mahy: The dictionary of virology. Elsevier, Amsterdam 2008, ISBN 0-12-373732-X .
- Susanne Modrow: Viren: Grundlagen, Krankheiten, Therapien. [Eine allgemeinverständliche Einführung für medizinische Laien]. Beck, München 2001. ISBN 3-406-44777-5 .
- Hartwig Klinker: Infektionen durch Viren. In: Marianne Abele-Horn (Hrsg.): Antimikrobielle Therapie. Entscheidungshilfen zur Behandlung und Prophylaxe von Infektionskrankheiten. (Unter Mitarbeit von Werner Heinz, Hartwig Klinker, Johann Schurz und August Stich) 2., überarbeitete und erweiterte Auflage, Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4 , S. 297–307.
- Marilyn J. Roossinck: Viren! Helfer, Feinde, Lebenskünstler – in 101 Porträts . Springer, Berlin 2018, ISBN 978-3-662-57543-7 .
- Sunit K. Singh (Hrsg.): Viral Infections and Global Change. [Über den Einfluss der Globalisierung und des Klimawandels auf die Verbreitung und Übertragung von Viren, speziell tropischen Viren]. Wiley-Blackwell, Hoboken NJ 2014, ISBN 978-1-118-29787-2 (Print); ISBN 978-1-118-29809-1 (eBook).
- Eugene V. Koonin, Tatiana G. Senkevich, Valerian V. Dolja: The ancient Virus World and evolution of cells. In: Biology Direct. 19. September 2006, Band 1, Artikel 29, doi:10.1186/1745-6150-1-29 , PMID 16984643 , PMC 1594570 (freier Volltext) (englisch).
Weblinks
- Viren: Aufbau, Spezifische Merkmale, Entwicklung, Zellbiologie, Unterscheidung zu Bakterien
- International Committee on Taxonomy of Viruses
- How viruses work
- Virusworld (aus Röntgenstrukturanalysen abgeleitete 3-D-Darstellungen von Viren)
- Wie Viren die Evolution des Menschen beflügelten
Einzelnachweise
- ↑ Karl Ernst Georges : Ausführliches lateinisch-deutsches Handwörterbuch . 8., verbesserte und vermehrte Auflage. Hahnsche Buchhandlung, Hannover 1918 ( zeno.org [abgerufen am 21. Januar 2020]).
- ↑ Duden online: Virus, das oder der
- ↑ Karin Mölling : Supermacht des Lebens. Reisen in die erstaunliche Welt der Viren. 1. Auflage, Beck, München 2015, ISBN 978-3-406-66969-9 .
- ↑ Zehntausende unbekannte Viren im Abwasser . Auf: scinexx.de vom 6. Oktober 2011, zuletzt abgerufen am 17. September 2014.
- ↑ International Committee on Taxonomy of Viruses (ICTV): Virus Taxonomy: 2020 Release. - EC 52, Online meeting: Oktober 2020; Email ratification: März 2021. Auf: talk.ictvonline.org ; zuletzt abgerufen am 17. Mai 2021.
- ↑ TA McAllister et al.: Ruminant Nutrition Symposium: Use of genomics and transcriptomics to identify strategies to lower ruminal methanogenesis. In: ACSESS DL. 2015 Archivierte Kopie ( Memento vom 7. April 2016 im Internet Archive ) doi:10.2527/jas.2014-8329
- ↑ Shmoop Biology: Phages Shmoop University, 2016.
- ↑ Pierer's Universal-Lexikon der Vergangenheit und Gegenwart . 4. Auflage. Verlagsbuchhandlung von HA Pierer , Altenburg 1865 ( zeno.org [abgerufen am 21. Januar 2020] Lexikoneintrag „Virus“).
- ↑ Death of the Rev. Dr. Peckwell In: The Times vom 23. August 1787, S. 2.
- ↑ Matthias Eckoldt: VIRUS - Partikel, Paranoia, Pandemien . Ecowin, Salzburg 2021, ISBN 978-3-7110-0275-4 , S. 61 .
- ↑ Florian Witzmann et al.: Paget disease of bone in a Jurassic dinosaur. In: Current Biology. Band 21, Nr. 17, R647-R648, 2011, doi:10.1016/j.cub.2011.08.006 ( Volltext als PDF-Datei ).
- ↑ R. Sanjuan, MR Nebot, N. Chirico, LM Mansky, R. Belshaw: Viral Mutation Rates . In: Journal of Virology . 84, Nr. 19, 2010, ISSN 0022-538X , S. 9733–9748. doi : 10.1128/JVI.00694-10 .
- ↑ JW Drake, JJ Holland: Mutation rates among RNA viruses. In: Proceedings of the National Academy of Sciences of the United States of America. 1999, Band 96, Nr. 24, S. 13910–3. PMID 10570172 , PMC 24164 (freier Volltext).
- ↑ Donald W. Klein, Lansing M. Prescott, John Harley: Microbiology . Wm. C. Brown, Dubuque, Iowa 1993, ISBN 0-697-01372-3 .
- ↑ MA Martinez et al.: Quasispecies Dynamics of RNA Viruses . In: G. Witzany (Hrsg.): Viruses: Essential Agents of Life . Springer, 2012, ISBN 978-94-007-4898-9 , S. 21–42.
- ↑ C Lauber, JJ Goeman, C Parquet Mdel, P Thi Nga, EJ Snijder, K Morita, AE Gorbalenya: The footprint of genome architecture in the largest genome expansion in RNA viruses . In: PLoS Pathog . Band 9, Nr. 7, Juli 2013, S. e1003500. doi : 10.1371/journal.ppat.1003500 .
- ↑ DA Steinhauer, JJ Holland: Rapid evolution of RNA viruses. In: Annual Review of Microbiology. 1987, Band 41, S. 409–33. PMID 3318675 .
- ↑ John B Carter, Venetia A Saunders: Virology: Principles and Applications. 1st edition, Wiley, Chichester UK 2007, ISBN 0-470-02387-2 , S. 6.
- ↑ Matthias G. Fischer, Michael J. Allen, William H. Wilson, and Curtis A. Suttle: Giant virus with a remarkable complement of genes infects marine zooplankton . In: Proceedings of the National Academy of Sciences . 2010. doi : 10.1073/pnas.1007615107 .
- ↑ Salvador Edward Luria, James E. Darnell : General Virology. 3. Auflage, John Wiley & Sons, New York ua 1978, ISBN 978-0-471-55640-4 .
- ↑ Luis P. Villarreal, Guenther Witzany: Viruses are essential agents within the roots and stem of the tree of life. In: Journal of Theoretical Biology. Band 262, Nr. 4, 2010, S. 698–710,doi:10.1016/j.jtbi.2009.10.014 .
- ↑ P. Forterre: The virocell concept and environmental microbiology . In: The ISME Journal . Band 7, 2012, S. 233–236. doi : 10.1038/ismej.2012.110 . PMC 3554396 (freier Volltext).
- ↑ David M. Needham, Susumu Yoshizawa, Toshiaki Hosaka ua: A distinct lineage of giant viruses brings a rhodopsin photosystem to unicellular marine predators . In: PNAS. 23. September 2019, doi:10.1073/pnas.1907517116 , ISSN 0027-8424 ( PDF ).
- ↑ Georg Löffler, Petro E Petrides (Hrsg.): Biochemie und Pathobiochemie (= Springer-Lehrbuch. ) 7., völlig neu bearbeitete Auflage, Springer, Berlin/ Heidelberg/ New York 2003, ISBN 3-540-42295-1 .
- ↑ David Moreira, Purificación López-García: Ten reasons to exclude viruses from the tree of life. In: Nature Reviews Microbiology . Band 7, April 2009, S. 306–311, doi:10.1038/nrmicro2108 .
- ↑ a b VJ Torres, DL Stauff et al.: A Staphylococcus aureus regulatory system that responds to host heme and modulates virulence. In: Cell host & microbe. 19. April 2007, Band 1, Nr. 2, S. 109–19, PMID 18005689 , PMC 2083280 (freier Volltext).
- ↑ G. Silvestri: Naturally SIV-infected sooty mangabeys: are we closer to understanding why they do not develop AIDS? In: Journal of Medical Primatology. 2005, Band 34, Nr. 5–6, S. 243–52, PMID 16128919 .
- ↑ MJ Pantin-Jackwood, DE Swayne: Pathogenesis and pathobiology of avian influenza virus infection in birds. In: Revue scientifique et technique (International Office of Epizootics). 2009, Band 28, Nr. 1, S. 113–36, PMID 19618622 .
- ↑ KD Mir, MA Gasper, V. Sundaravaradan, DL Sodora: SIV infection in natural hosts: resolution of immune activation during the acute-to-chronic transition phase. In: Microbes and Infection. 2011, Band 13, Nr. 1, S. 14–24, PMID 20951225 , PMC 3022004 (freier Volltext).
- ↑ MJ. Adams, EJ. Lefkowitz, AM. King, EB. Carstens: Recently agreed changes to the International Code of Virus Classification and Nomenclature . In: Archives of Virology . Band 158, Nr. 12, Dezember 2013, S. 2633–9. doi : 10.1007/s00705-013-1749-9 . PMID 23836393 .
- ↑ International Committee on Taxonomy of Viruses Executive Committe , Virus Taxonomy: 2018 Release , How to write virus and species names
- ↑ International Committee on Taxonomy of Viruses Executive Committee :The new scope of virus taxonomy: partitioning the virosphere into 15 hierarchical ranks. In: Nature Microbiology. Band 5, S. 668–674 vom 27. April 2020, doi:10.1038/s41564-020-0709-x ; sowie Nadja Podbregar: Ein Stammbaum für die Virosphäre. Auf: scinexx.de vom 29. April 2020. Beide Artikel haben inhaltlich den Stand von Januar 2020, dh Einzelheiten der Master Species List (MSL) Nr. 35 des ICTV vom März 2020 sind noch nicht alle berücksichtigt. Für die grundsätzliche Intention des ICTV hat das aber keine Bedeutung, die Entwicklung ist mit der MSL#35 lediglich in der vorgegebenen Richtung schon wieder weitergegangen.
- ↑ International Committee on Taxonomy of Viruses (ICTV): ICTV Master Species List 2018b.v2 (MSL #34v)
- ↑ Susanne Modrow, Dietrich Falke, Uwe Truyen: Molekulare Virologie. 2. Auflage, Spektrum – Akademischer Verlag, Heidelberg/ Berlin 2003, ISBN 3-8274-1086-X .
- ↑ Th. Mertens, O. Haller, H.-D. Klenk (Hrsg.): Diagnostik und Therapie von Viruskrankheiten – Leitlinien der Gesellschaft für Virologie. 2. Auflage, Elsevier/ Urban & Fischer, München 2004, ISBN 3-437-21971-5 .
- ↑ Thomas Berg, Norbert Suttorp: Infektionskrankheiten. Thieme, Stuttgart 2004, ISBN 3-13-131691-8 .
- ↑ ICTV: How to write virus, species, and other taxa names
- ↑ Lexikon der Medizinischen Laboratoriumsdiagnostik . S. 402–403: Barmah-Forest-Viren (BFV).
- ↑ Gerhard Dobler, Horst Aspöck: Durch Stechmücken übertragene Arboviren als Erreger von Infektionen des Menschen. In: Horst Aspöck (Hrsg.): Krank durch Arthropoden (= Denisia. Band 30). Biologiezentrum (Oberösterreichische Landesmuseen in Linz), 2010, ISSN 1608-8700 , hier S. 518: Barmah Forest-Fieber. – 2.6.4. Klinik ( Volltext als PDF ).
- ↑ Centers for Disease Control and Prevention (CDC): Eastern Equine Encephalitis . Auf: cdc.gov vom 5. April 2016; zuletzt abgerufen am 30. August 2016.
- ↑ Adriana Delfraro, Analía Burgueño, Noelia Morel ua: Fatal Human Case of Western Equine Encephalitis, Uruguay. In: Emerging Infectious Diseases. Band 17, Nr. 5, Mai 2011, S. 952–954 → Letters, doi:10.3201/eid1705.101068 ( Volltext als PDF-Datei ).
- ↑ ResearchGate, Presence of Mopeia Virus, an African Arenavirus. November 2011, abgerufen am 23. Mai 2019 .
- ↑ Robert Koch-Institut - Merkblatt: Informationen zur Vermeidung von Infektionen mit dem Borna Disease Virus 1. Auf: rki.de ; abgerufen am 5. Dezember 2020.
- ↑ Bundesministerium für Bildung und Forschung: Infektionsforschung - Feldspitzmäuse können tödliches Bornavirus übertragen. Auf: bmbf.de vom 08. Januar 2020 , zuletzt abgerufen am 5. Dezember 2020.
- ↑ Bernd Hoffmann, Dennis Tappe, Dirk Höpe ua: A Variegated Squirrel Bornavirus Associated with Fatal Human Encephalitis. In: The New England Journal of Medicine. 2015, Band 373, S. 154–16, doi:10.1056/NEJMoa1415627 .
- ↑ MSD-Manual: Rezidivierende respiratorische Papillomatose (Larynxpapillomen). Auf: msdmanuals.com Stand vom Februar 2019; zuletzt abgerufen am 29. April 2021.
- ↑ NCBI: Dependovirus (genus)
- ↑ D. Martin, JS Gutkind: Human tumor-associated viruses and new insights into the molecular mechanisms of cancer . In: Oncogene . Band 27, Nr. 2, 2008, S. 31–42. PMID 19956178 .
- ↑ C. Zimmer: Krebs – eine Nebenwirkung der Evolution? In: Spektrum der Wissenschaft. Nr. 9, 2007, S. 80–88.
- ↑ M. Stadtfeld et al.: Induced Pluripotent Stem Cells Generated Without Viral Integration. Auf: science-online vom 25. September 2008, doi:10.1126/science.1162494 .
- Virologie
- Viren, Viroide und Prionen